题目内容
10.(1)请将5种物质:N2O、FeCl2、Fe(NO3)3、HNO3和FeCl3分别填入下面对应的横线上,组成一个未配平的化学方程式.HNO3+FeCl2→N2O+Fe(NO3)3+FeCl3+H2O
(2)反应物中发生氧化反应的物质FeCl2,被还原的元素是N.
(3)反应中1mol氧化剂得到(填“得到”或“失去”)4 mol电子.
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中.
30HNO3+24FeCl2.
分析 (1)元素处于最高价只有氧化性,元素居于低价有还原性,根据所给物质的化合价情况来分析;
(2)在氧化还原反应中,还原剂发生氧化反应,化合价降低的元素被还原;
(3)根据电子守恒配平方程式并进行相应的计算;
(4)根据配平的方程式来回答,找到反应物以及量的多少情况.
解答 解:(1)所给的物质组合中,HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,得电子数是4mol,能将还原性的4molFeCl2氧化为Fe(NO3)3,4mol物质失电子数是4mol,根据氢原子守恒,水在生成物中,故发生的反应为:HNO3+FeCl2→N2O+Fe(NO3)3+FeCl3+H2O,
故答案为:HNO3;FeCl2;N2O;Fe(NO3)3;FeCl3;
(2)还原剂FeCl2发生氧化反应,化合价降低的N元素被还原,故答案为:FeCl2;N;
(3)反应中铁元素的化合价升高1价,氮元素化合价共降低了4价,所以硝酸是氧化剂,1mol氧化剂得到了4mol电子,故答案为:得到;4;
(4)HNO3中氮元素化合价位于最高价,具有氧化性,对应还原产物为N2O,总共得电子数是8mol,能将还原性的FeCl2氧化为FeCl3,物质失电子数是3mol,根据电子守恒,转移电子为24mol,生成N2O的物质的量为3mol,发生的反应为30HNO3+24FeCl2═3N2O+16FeCl3+8Fe(NO3)3+15H2O,
故答案为;30HNO3、24FeCl2.
点评 本题考查氧化还原反应中的概念和电子守恒知识,综合性较强,有一定的难度.

练习册系列答案
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案
相关题目
6.下列叙述正确的是( )
| A. | 13C和14C属于同一种元素,也属于同一种核素 | |
| B. | 1H和2H是不同的核素,两者互为同位素 | |
| C. | H2O和D2O互为同素异形体 | |
| D. | 金刚石和石墨都是碳元素形成的单质,具有相同的物理化学性质 |
1. 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
①图中表示NO2变化的曲线是b,用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
②能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
②能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
18.欲将蛋白质从水中析出而又不改变它的性质,应加入( )
| A. | 福尔马林 | B. | 18.4 mol•L-1的硫酸溶液 | ||
| C. | 饱和Na2SO4溶液 | D. | 1 mol•L-1的CuSO4溶液 |
5.下列叙述中正确的是( )
| A. | 在稀溶液中,1mol酸和1mol碱完全反应所放出的热量叫做中和热 | |
| B. | 在101kPa时,1mol物质燃烧时的反应热叫做该物质的燃烧热 | |
| C. | 对于热化学方程式S(s)+O2(g)═SO2(g)△H1 S(g)+O2(g)═SO2(g)△H2,化学反应的△H前者大于后者 | |
| D. | 如果反应物所具有的总能量低于生成物所具有的总能量,则发生的反应是放热反应 |
15.下列说法正确的是( )
| A. | 一定温度下,反应MgCl2(l)═Mg(l)+Cl2(g)的△H>0△S>0 | |
| B. | 水解反应NH4++H2O?NH3•H2O+H+的△H<0 | |
| C. | 水能、电能、天然气都是可再生能源 | |
| D. | 凡是化合反应都是放热反应,分解反应都是吸热反应 |
19.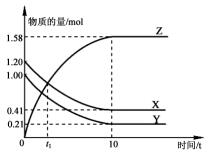 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | t1时,Z和X的浓度相等,达到了化学平衡状态 | |
| C. | 反应开始到10 s时,Y的正逆反应速率都相等 | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
20.2011国际化学年主题是“化学-我们的生活,我们的未来”.下列叙述正确的是( )
| A. | 利用太阳能、潮汐能、煤炭发电,以获取清洁能源 | |
| B. | 反应热等于恒压体系中,反应过程产生的焓变 | |
| C. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 |
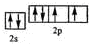 ,该元素的名称是氧;
,该元素的名称是氧;