题目内容
11.下列各组顺序的排列正确的是( )| A. | 单质氧化性:I2>Br2>Cl2 | B. | 热稳定性:PH3>H2S>HCl | ||
| C. | 酸性强弱:HIO4>HBrO4>HClO4 | D. | 碱性强弱:KOH>NaOH>Mg(OH)2 |
分析 A.随着原子序数的递增,卤素单质氧化性逐渐减弱;
B.非金属性越强,对应氢化物越稳定;
C.非金属性越强,最高价氧化物对应水合物的酸性越强;
D.金属性越强,最高价氧化物对应水合物的碱性越强.
解答 解:A.卤族元素中,随着原子序数的递增,非金属性逐渐减弱,对应单质氧化性逐渐减弱,则氧化性强弱为:I2<Br2<Cl2,故A错误;
B.非金属性:P<S<Cl,则对应氢化物的热稳定性:PH3<H2S<HCl,故B错误;
C.非金属性:I<Br<Cl,则最高价氧化物对应水合物的酸性大小为:HIO4<HBrO4<HClO4,故C错误;
D.金属性:K>Na>Mg,则最高价氧化物对应水合物的碱性强弱为:KOH>NaOH>Mg(OH)2,故D正确;
故选D.
点评 本题考查了元素周期律的实质及应用,题目难度不大,明确元素周期律内容为解答关键,注意熟练掌握原子结构与元素周期律的关系,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
相关题目
1. 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
①图中表示NO2变化的曲线是b,用O2表示从0~2s内该反应的平均速率v=0.0015mol/(L•s).
②能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
 800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:
800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)?2NO2(g),在反应体系中,n(NO)随时间的变化如表所示:| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
②能说明该反应已经达到平衡状态的是bc
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变.
19.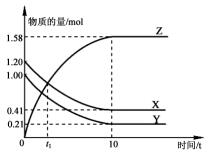 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
 一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )
一定温度下,在1L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示.下列描述正确的是( )| A. | 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L•s) | |
| B. | t1时,Z和X的浓度相等,达到了化学平衡状态 | |
| C. | 反应开始到10 s时,Y的正逆反应速率都相等 | |
| D. | 反应的化学方程式为:X(g)+Y(g)?Z(g) |
6.下列化学方程式或离子方程式正确的是( )
| A. | 溴苯的制备: | |
| B. | 1,3-戊二烯发生加聚反应 | |
| C. | 苯酚钠溶液中通入少量二氧化碳: | |
| D. | 醇可以制备卤代烃,如 |
16.丙烯醇(CH2═CH-CH2OH)可发生的化学反应有( )
①加成②氧化③酯化④加聚⑤取代.
①加成②氧化③酯化④加聚⑤取代.
| A. | 只有①②③ | B. | 只有①②③④ | C. | ①②③④⑤ | D. | 只有①③④ |
3.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )


| A. | 甲能使酸性KMnO4溶液褪色 | |
| B. | 乙可与溴水发生加成反应而使溴水褪色 | |
| C. | 丙与浓硫酸、浓硝酸的混合液共热发生取代反应 | |
| D. | 丁可与NaHCO3发生取代反应 |
20.2011国际化学年主题是“化学-我们的生活,我们的未来”.下列叙述正确的是( )
| A. | 利用太阳能、潮汐能、煤炭发电,以获取清洁能源 | |
| B. | 反应热等于恒压体系中,反应过程产生的焓变 | |
| C. | 所有燃烧反应都是放热反应,所以不需吸收能量就可以进行 | |
| D. | 纳米铜能在氧气中燃烧,说明了纳米铜比普通铜的还原性强 |
1.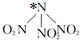 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
 科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )
科学家最近研制出可望成为高效火箭推进剂的 N(NO2)3,如图,已知该分子中 N-N-N 键角都是 108.1°,下列有关N(NO2)3的说法不正确的是( )| A. | 分子中 N、O 间形成的共价键是极性键 | |
| B. | 图中加“*”N原子的杂化方式为sp3 | |
| C. | 该物质既有氧化性又有还原性 | |
| D. | 15.2g 该物质含有 6.02×1022个原子 |
 ,该元素的名称是氧;
,该元素的名称是氧;