题目内容
20.下列元素位于d区的是( )| A. | C | B. | Ca | C. | Cr | D. | Ga |
分析 s区元素,包括ⅠA、ⅡA及He元素;p区元素,主要为主族和0族元素,包括ⅢA~ⅤⅡA元素及0族元素(He除外);d区元素,包括ⅢB~ⅤⅡB和ⅤⅢ族(锕系、镧系除外),为过渡元素;ds区元素,包括ⅠB、ⅡB元素,为过渡金属,由此分析解答.
解答 解:A、碳位于p区,故A不选;
B、钙位于s区,故B不选;
C、24号铬价电子排布为:3d54s1,位于ⅥB族,位于d区,故C选;
D、Ga是ⅢA,所以位于s区,故D不选;
故选C.
点评 本题考查结构与物质关系,难度不大,注意掌握元素周期表中各区的划分.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
10.某有机物结构如图,它不可能具有的性质是( )


| A. | 能跟KOH溶液反应 | B. | 能被氧化 | C. | 能发生加聚反应 | D. | 能使溴水褪色 |
8.下列有关试剂保持或实验操作的叙述正确的是( )
| A. | 浓硝酸保存在棕色橡胶塞的试剂瓶中 | |
| B. | 用溴的四氯化碳溶液除去甲烷中的乙烯杂质 | |
| C. | 酸碱中和滴定实验中,锥形瓶用蒸馏水洗涤后,不需要干燥 | |
| D. | 配制NH4Fe(SO4)2标准溶液时,加入一定量HCl以防水解 |
15.按如图所示装置进行下列不同的操作,其中不正确的是( )
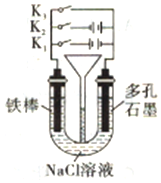

| A. | 铁腐蚀的速度由大到小的顺序:只闭合K3>只闭合K1>都断开>只闭合K2 | |
| B. | 只闭合K3,正极的电极反应式:2H2O+O2+4e-=4OH- | |
| C. | 先只闭合K1,一段时间后,漏斗内液曲上升,然后再只闭合K2,漏斗内液面上升 | |
| D. | 只闭合K2,U型管左、右两端液面均下降 |
5.下列微粒的立体结构的名称正确的是( )
| A. | SO2 直线形 | B. | NH4+正四面体形 | C. | CS2 平面三角形 | D. | BF3 三角锥形 |
12.NA表示阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol-CH3中含有的质子数为10NA | |
| B. | 标准状况下,22.4LNO和11.2LO2混合,生成物中含有NA个分子 | |
| C. | 物质的量相等的Na2O2和Na2O所含有的阴离子数目为NA | |
| D. | H2O2+Cl2═2HCl+O2反应中,每生成32gO2,转移2NA个电子 |
9.同温同压下,将四个容积相同的干燥圆底烧瓶中分别充满①NH3、②NO2、③混有空气的NH3、④混有空气的NO2进行喷泉实验.最后烧瓶内溶液的物质的量浓度(假设烧瓶内溶液不扩散)大小关系是( )
| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ④>①=②=③ |
10. 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
(1)实验①②表明同周期元素从左往右金属性逐渐减小(填“增大”、“减小”或“不变”).
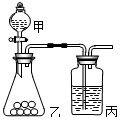
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
 某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:
某同学探究同周期元素性质的递变规律,并讨论影响化学反应速率的因素,选用的试剂如下,镁条、铝条、钠、高锰酸钾固体、Na2S溶液、浓盐酸、0.5mol/L的盐酸,酚酞试液,其设计的实验方案及部分实验现象如下表:请回答下列问题:| 实验步骤 | 实验现象 |
| ①将一小块金属钠放入滴有酚酞试液的冷水中 | 钠块浮在水面上,熔化成闪亮的小球,做不定向移动,随之消失,溶液变红色 |
| ②将表面积大致相同的镁条和铝条(均已用砂纸打磨过),分别投入足量的相同体积的0.5mol/L的盐酸中 | 镁条剧烈反应,迅速产生大量的无色气体,而铝条反应不十分剧烈,产生无色气体,镁条消失比铝条快 |
(2)已知高锰酸钾常温下可氧化浓盐酸生成氯气.用右图所示装置比较氯与硫的非金属性.甲、乙所装药品分别为浓盐酸、硫化钠溶液 .装置丙中实验现象为有淡黄色沉淀生成,离子方程式为S2-+Cl2=2Cl-+S↓
(3)由实验②可得出决定化学反应快慢的主要因素是反应物本身的性质.
(4)请设计一个实验方案证明浓度对反应速率的影响:在相同的温度下,采用相同状态的质量相同的铝片(或镁条)分别与体积相同的0.5mol/L的盐酸和浓盐酸反应.
 ,名称是乙烯.
,名称是乙烯. ,名称是聚乙烯.
,名称是聚乙烯.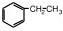 、
、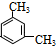 .
. .属于取代反应反应类型.
.属于取代反应反应类型.