题目内容
5.下列微粒的立体结构的名称正确的是( )| A. | SO2 直线形 | B. | NH4+正四面体形 | C. | CS2 平面三角形 | D. | BF3 三角锥形 |
分析 根据价层电子对互斥理论确定微粒空间构型,价层电子对个数=σ键+孤电子对个数,孤电子对个数=$\frac{1}{2}$×(a-xb),a为中心原子的价电子数,x为与中心原子结合的原子个数,b为与中心原子结合的原子最多能接受的电子数,据此判断.
解答 解:A.SO2中S形成2个σ 键,孤电子对数=$\frac{1}{2}×$(6-2×2)=1,原子价层电子对=2+1=3,采取sp2杂化方式,分子构型为平面三角形,故A错误;
B.NH4+离子中N原子价层电子对=4+$\frac{1}{2}$×(5-4-1)=4,采取sp3杂化,其空间构型为正四面体,故B正确;
C.CS2中C原子价层电子对=$\frac{1}{2}$×(4+0)=2,采取sp杂化方式,分子构型为直线型,故C错误;
D.BF3分子的中心原子B原子上含有3个σ 键,中心原子上的孤电子对数=$\frac{1}{2}$(3+1×3)=0,采取sp2杂化方式,所以其空间构型就是平面三角形,故D错误;
故选B.
点评 本题考查了微粒空间构型的判断,根据价层电子对理论解答,注意孤电子对个数=$\frac{1}{2}$×(a-xb)中各个字母的含义,SO2 中O原子价层电子对个数,为易错点,也是该题的难点,题目难度中等.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
15.将浓度均为0.2mol/L的CH3COOH和CH3COONa溶液等体积混合,混合液呈弱酸性,其中有三种微粒的浓度非常接近,这三种微粒是( )
| A. | CH3COO- Na+ CH3COOH | B. | CH3COO- CH3COOH H+ | ||
| C. | CH3COOH OH- H+ | D. | CH3COO- OH- H+ |
20.下列元素位于d区的是( )
| A. | C | B. | Ca | C. | Cr | D. | Ga |
10.下述实验设计或操作正确的是( )
| 选项 | 实验目的 | 实验设计 |
| A | 除去铝箔上少量的氧化膜 | 将铝箔放入 NaOH 溶液中洗涤 |
| B | 排水法收集 KMnO4分解产生的 O2 | 先熄灭酒精灯,后移出导管 |
| C | 检验溶液中是否含有 Fe2+ | 向溶液中滴入氯水后,再滴加 KSCN 溶液 |
| D | 证明 H2SO4酸性比 H2CO3 强 | 把稀 H2SO4 滴入 NaHCO3 溶液 |
| A. | A | B. | B | C. | C | D. | D |
17.“可呼吸”钠-二氧化碳电池的工作原理为4Na+3CO2$?_{充电}^{放电}$2Na2CO3+C.下列叙述错误的是( )
| A. | 放电时,Na+由负极向正极移动 | |
| B. | 充电时,阴极反应式为Na++e-═Na | |
| C. | 电解质溶液可选NaClO4水溶液 | |
| D. | 电池放电时把二氧化碳变废为宝,有重要的研发意义 |
14.下列实验操作、现象与结论均正确的是( )
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将过量SO2通入BaCl2溶液中 | 先有白色沉淀生成,后沉淀消失 | 最终生成Ba(HSO3)2 |
| B | 将Cl2通入石蕊试液中 | 先变红后褪色 | Cl2有漂白性 |
| C | 将氨气通入到盛有氯化铝的溶液中 | 先生成白色沉淀,后白色沉淀消失 | 氨水能与氢氧化铝反应 |
| D | 将少量溴水滴加到KI溶液中,再加入CCl4振荡、静置 | 溶液分层,上层无色,下层紫红色 | 氧化性:Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
15.(CH3)2C(C2H5)CH(CH3)2的名称是( )
| A. | 2,3,3-三甲基戊烷 | B. | 3,3,4-三甲基戊烷 | ||
| C. | 2,3-二甲基-2-乙基丁烷 | D. | 2,3-二甲基-3-乙基丁烷 |
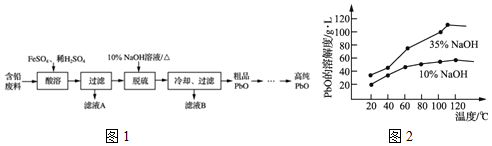
 甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.
甲醛是深受关注的有机化合物.甲醛含量的测定有多种方法,例如:在调至中性的亚硫酸钠溶液中加入甲醛水溶液,经充分反应后,产生的氢氧化钠的物质的量与甲醛的物质的量相等,然后用已知浓度的硫酸滴定氢氧化钠.