题目内容
9.同温同压下,将四个容积相同的干燥圆底烧瓶中分别充满①NH3、②NO2、③混有空气的NH3、④混有空气的NO2进行喷泉实验.最后烧瓶内溶液的物质的量浓度(假设烧瓶内溶液不扩散)大小关系是( )| A. | ①>②>③>④ | B. | ①=②=③=④ | C. | ①=②=③>④ | D. | ④>①=②=③ |
分析 气体的体积相等,相同条件下气体的物质的量相等,令气体的物质的量为3mol,则烧瓶的容积为3×22.4L.再判断烧瓶中溶液的体积、溶质的物质的量,再根据物质的量浓度公式判断浓度比.
①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积;
②纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的$\frac{2}{3}$;
③混有空气的NH3氨气,完全溶于水;
④混有少量O2的NO2气体,把NO2分成两部分:
第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO,
这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分得到的浓度小了,故比只有NO2气体浓度小.
解答 解:①纯净的氨气,完全溶于水,溶液的体积等于烧瓶容积,所以溶液浓度为$\frac{3mol}{3mol×22.4L/mol}$=$\frac{1}{22.4}$mol/L;
②纯净的NO2气体,发生反应3NO2+H2O=2HNO3+NO,生成硝酸2mol,1molNO,所以溶液体积等于烧瓶容积的$\frac{2}{3}$,所以溶液的物质的量浓度为$\frac{2mol}{2×22.4L}$=$\frac{1}{22.4}$mol/L;
③设氨气的物质的量为nmol,溶液体积等于烧瓶容积的n×22.4=22.4n,所以溶液物质的量浓度为$\frac{n}{22.4n}$=$\frac{1}{22.4}$mol/L;
④混有少量O2的NO2气体,把NO2分成两部分:第一部分:4NO2+O2+2H2O=4HNO3,由于O2很少,故还有:第二部分:3NO2+H2O=2HNO3+NO.这样第一部分反应中,5份的气体(4NO2+O2)生成4份HNO3,这部分溶液体积等于二氧化氮与氧气的体积,故这部分的浓度为$\frac{4mol}{5×22.4L}$=$\frac{1}{28}$mol/L,第二部分浓度为=$\frac{1}{22.4}$mol/L.所以比只有NO2气体形成的溶液浓度小.
故溶液浓度①=②=③>④.
故选:C.
点评 考查物质的量浓度计算,浓度中等,注意④中把整体分为两部分考虑.关键是判断溶液体积与气体的体积关系.

 新编小学单元自测题系列答案
新编小学单元自测题系列答案| A. | Na2CO3过量 | B. | Na2CO3恰好与醋酸完全反应 | ||
| C. | 两种酸都过量 | D. | 两种酸的物质的量浓度相同 |
| A. | C | B. | Ca | C. | Cr | D. | Ga |
| A. | 放电时,Na+由负极向正极移动 | |
| B. | 充电时,阴极反应式为Na++e-═Na | |
| C. | 电解质溶液可选NaClO4水溶液 | |
| D. | 电池放电时把二氧化碳变废为宝,有重要的研发意义 |
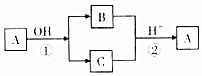 A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )
A是中学化学中常见的单质,B、C为化合物.它们有如图所示的转化关系(部分产物及反应条件省略).下列判断正确的是( )| A. | A可能是金属,也可能是非金属 | B. | A、B、C含有一种相同的元素 | ||
| C. | B、C的水溶液一定都呈碱性 | D. | 反应①②不一定都是氧化还原反应 |
| 选项 | 实验操作 | 实验现象 | 实验结论 |
| A | 将过量SO2通入BaCl2溶液中 | 先有白色沉淀生成,后沉淀消失 | 最终生成Ba(HSO3)2 |
| B | 将Cl2通入石蕊试液中 | 先变红后褪色 | Cl2有漂白性 |
| C | 将氨气通入到盛有氯化铝的溶液中 | 先生成白色沉淀,后白色沉淀消失 | 氨水能与氢氧化铝反应 |
| D | 将少量溴水滴加到KI溶液中,再加入CCl4振荡、静置 | 溶液分层,上层无色,下层紫红色 | 氧化性:Br2>I2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 在滴加过程中,Kw始终保持不变 | |
| B. | 25℃时,反应后溶液中c(NH4+)>c(CH3COO-) | |
| C. | 若用氨水标准溶液滴定盐酸,则应选择酚酞作为指示剂 | |
| D. | 25℃时,反应NH4++H2O?NH3•H2O+H+的平衡常数约为5.6×10-10 |
| A. | HNO3、Ba(NO3)2、AgNO3 | B. | Ba(NO3)2、AgNO3、HNO3 | ||
| C. | 酚酞、Ba(NO3)2、AgNO3 | D. | HCl、BaCl2、AgNO3 |
| 化学性质 | 实际应用 | |
| A | SiCl4与水反应时生成白色烟雾 | SiCl4在战争中可用作烟雾弹 |
| B | 铁比铜金属性强 | FeCl3腐蚀Cu刻制印刷电路板 |
| C | MgO是一种电解质 | 工业电解冶炼金属镁 |
| D | 铝耐腐蚀 | 用铝质容器研制咸菜 |
| A. | A | B. | B | C. | C | D. | D |