题目内容
18.断裂1mo1Cl-Cl键吸收QkJ能量,则2molCl原子所具有的能量比1molCl2具有的能量( )| A. | 低QkJ | B. | 低2QkJ | C. | 高QkJ | D. | 高2QkJ |
分析 断裂1mo1Cl-Cl键吸收QkJ能量,则有Cl2=2Cl△H=QkJ/mol,以此解答该题.
解答 解:断裂1mo1Cl-Cl键吸收QkJ能量,即1molCl2吸收QkJ能量可生成2molCl原子,则2molCl原子所具有的能量比1molCl2具有的能量高QkJ.
故选C.
点评 本题考查化学反应与能量的变化,为高频考点,侧重于学生的分析能力以及基本概念的理解,难度不大,注意相关基础知识的积累.

练习册系列答案
 小学期末标准试卷系列答案
小学期末标准试卷系列答案
相关题目
8.下列说法错误的是( )
| A. | 以2-氯丙烷为主要原料制备1,2-丙二醇[CH3CH(OH)CH2OH]时,依次经过的反应类型为消去反应-加成反应-取代反应 | |
| B. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| C. | 有机物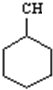 的一氯代物有4种 的一氯代物有4种 | |
| D. | 乙烷和丙烯的物质的量共1mol,完全燃烧生成3molH2O |
9.某同学探究溶液的酸碱性对FeCl3水解平衡的影响,实验方案如下:
配制50mL0.001mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1mol/L HCl溶液、1滴1mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如图所示.下列说法不正确的是( )
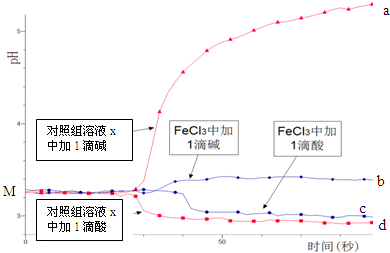
配制50mL0.001mol/L FeCl3溶液、50mL对照组溶液x,向两种溶液中分别滴加1滴1mol/L HCl溶液、1滴1mol/L NaOH 溶液,测得溶液pH随时间变化的曲线如图所示.下列说法不正确的是( )

| A. | 依据M点对应的pH,说明Fe3+发生了水解反应 | |
| B. | 对照组溶液x的组成可能是0.003 mol/L KCl | |
| C. | 依据曲线c和d说明Fe3+水解平衡发生了移动 | |
| D. | 通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向 |
13.下列说法正确的是( )
| A. | 各元素的最高正化合价跟族的序数相等 | |
| B. | 所有元素都有正化合价和负化合价,它们的绝对值之和等于8 | |
| C. | 非金属元素的负化合价,等于原子最外层达到8个电子稳定结构所需得到的电子数 | |
| D. | 各元素原子的最外层电子数跟族序数相等 |
10.下列有关物理性质的比较不正确的是( )
| A. | 熔点:MgO>CaS | B. | 熔点:Li>Na | ||
| C. | 沸点:SiCl4>CF4 | D. | 沸点:邻硝基苯酚>间硝基苯酚 |
7.纯碱水解的化学方程式如下:Na2CO3+H2O?NaHCO3+NaOH.将纯碱的水溶液加热蒸发、灼烧,可得到的物质是( )
| A. | 只有氢氧化钠 | B. | 碳酸钠和氢氧化钠 | ||
| C. | 碳酸氢钠和氢氧化钠 | D. | 只有碳酸钠 |
17.已知在298K时,Ksp[Cu(OH)2]=2.2×10-20,Ksp(CuS)=1.3×10-36,Ksp(FeS)=6.3×10-18.取适量的CuSO4溶液,滴加NaOH溶液直到沉淀完全,所得溶液pH=10,则下列说法错误的是( )
| A. | 所得溶液中水电离出c(OH-)=1.0×10-10mol•L-1 | |
| B. | 所得溶液中的c(Cu2+)=1.0×10-5mol•L-1 | |
| C. | 向所得溶液中滴加Na2S溶液会有黑色沉淀出现 | |
| D. | 除去工业废水中的Cu2+,可以用FeS作沉淀剂 |

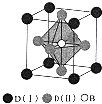 A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题:
A、B、C、D是周期表中序数依次增大的前四周期元素,A的最高正价与最低负价代数和为零,常温常压下B、C的单质呈气态,A22-、B2、C22+互为等电子体,基态D3+的M层有5个能量和自旋方向均相同的电子,回答下列问题: