题目内容
2.已知氢气和氧气反应生成4.5g水蒸气,同时放出60.45kJ的热量,则下列热化学方程式正确的是( )| A. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-483.6kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-241.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-241.8kJ/mol |
分析 n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,同时放出60.45kJ的热量,则生成1mol蒸气,同时放出热量为$\frac{60.45kJ}{0.25}$=241.8kJ,结合物质的状态、焓变书写热化学方程式.
解答 解:n(H2O)=$\frac{4.5g}{18g/mol}$=0.25mol,同时放出60.45kJ的热量,则生成1mol蒸气,同时放出热量为$\frac{60.45kJ}{0.25}$=241.8kJ,则该反应的热化学方程式为H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol或2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol,
故选A.
点评 本题考查反应热与焓变,为高频考点,把握物质的量与热量的关系、热化学方程式的书写为解答的关键,侧重分析与应用能力的考查,注意水的状态,题目难度不大.

练习册系列答案
相关题目
13.化学与社会、生活密切相关.下列叙述错误的是( )
| A. | 用活性炭做净化剂去除冰箱中异味 | |
| B. | Fe2O3俗称铁红,常用作红色油漆和涂料 | |
| C. | 推广应用燃料“脱硫、脱硝”技术,可减少硫氧化物和氮氧化物对空气的污染 | |
| D. | 在食品袋中放入盛有CaCl2•6H2O和铁粉的透气小袋,可防止食物受潮、氧化变质 |
10.下列事实与胶体性质无关的是( )
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
17.设NA表示阿伏加德罗常数的数值,下列叙述中正确的是( )
| A. | 1 mol NH3所含有的电子数为17NA | |
| B. | 常温常压下,22.4 L氧气所含的原子数为2NA | |
| C. | 常温常压下,48g O3所含的氧原子数为3NA | |
| D. | 1 mol/L NaCl溶液中所含的Na+数为NA |
7.下列说法正确的是( )
| A. | 氧化还原反应中氧化剂和还原剂一定是两种物质 | |
| B. | 氧化还原反应中氧化产物和还原产物一定是两种物质 | |
| C. | 作氧化剂的物质一定不能作还原剂 | |
| D. | 所含元素处于中间价态时的物质,既可作氧化剂也可作还原剂 |
5.下列有关胶体的叙述正确的是( )
| A. | Fe(OH)3胶体有丁达尔效应是Fe(OH)3胶体区别于FeCl3溶液最本质的特征 | |
| B. | 阳光穿透清晨的树林时形成的光柱,是胶体的丁达尔效应的体现 | |
| C. | 鸡蛋清溶液分类上属于悬浊液 | |
| D. | 向FeCl3溶液中加入NaOH溶液,会出现红褐色Fe(OH)3胶体 |

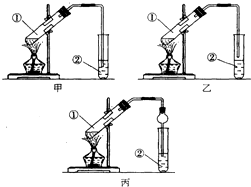 下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.
下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务.