题目内容
7.氨气在工业上有广泛用途.请回答以下问题:(1)工业上利用N2(g)+3H2(g)?2NH3(g)△H<0合成氨,某小组为了探究外界条件对该反应的影响,以c0mol/L H2参加合成氨反应,在a、b两种条件下分别达到平衡,如图A.

①相对a而言,b可能改变的条件是增大c(N2),判断的理由是a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大.
②a条件下,0~t0的平均反应速率v(N2)=$\frac{{c}_{0}-{c}_{1}}{300{t}_{0}}$mol•L-1•min-1.
(2)有人利用NH3和NO2构成电池的方法,既能实现有效消除氮氧化物的排放减少环境污染,又能充分利用化学能进行粗铝的精炼,如图B所示,e极为精铝.
a极通入NO2气体(填化学式),判断的理由是e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气
(3)某小组往一恒温恒压容器充入9mol N2和23mol H2模拟合成氨反应,图C为不同温度下平衡混合物中氨气的体积分数与总压强(p)的关系图.若体系在T2、60MPa下达到平衡.
①能判断N2(g)+3H2(g)?2NH3(g)达到平衡的是bd(填序号).
a.容器内压强不再发生变化 b.混合气体的密度不再发生变化
c.v正(N2)=3v逆(H2) d.混合气体的平均相对分子质量不再发生变化
②若T1、T2、T3温度下的平衡常数分别为K1、K2、K3,则K1、K2、K3由大到小的排序为K1>K2>K3.
③此时N2的平衡分压为9MPa.(分压=总压×物质的量分数)
计算出此时的平衡常数Kp=0.043(MPa)-2.(用平衡分压代替平衡浓度计算,结果保留2位有效数字并带上单位)
分析 (1)①a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动;
②a条件下,0~t0的平均反应速率v(N2)=$\frac{1}{3}$ v(H2)=$\frac{1}{3}$×$\frac{△c}{△t}$;
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应;
(3)①可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量、物质的量浓度、百分含量以及由此引起的一系列物理量不变;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=$\frac{x}{9-0.5x+23-1.5x+x}$×100%=60%,
x=12,
氮气分压=$\frac{9-0.5×12}{9+23-12}$×60MPa;此时的平衡常数Kp等生成物压强幂之积与反应物压强幂之积的比.
解答 解:(1)①a、b氢气起始浓度相同,b到达平衡的时间缩短,说明反应速率增大,平衡时氢气的浓度减小,说明平衡正向移动,所以改变的条件是增大c(N2),
故答案为:增大c(N2);a、b起始浓度相同,b到达平衡的时间缩短且氢气的转化率增大;
②a条件下,0~t0的平均反应速率v(N2)=$\frac{1}{3}$ v(H2)=$\frac{1}{3}$×$\frac{△c}{△t}$=$\frac{1}{3}$×$\frac{({c}_{0}-{c}_{1})mol/L}{100{t}_{0}min}$=$\frac{{c}_{0}-{c}_{1}}{300{t}_{0}}$mol/(L.min),
故答案为:$\frac{{c}_{0}-{c}_{1}}{300{t}_{0}}$;
(2)根据图知,e为精铝,为电解池阴极,d为阳极,所以通入a的电极是正极、通入b的电极是负极,原电池中NH3和NO2构成原电池,负极上失电子发生氧化反应,正极上得电子发生还原反应,原电池中二氧化氮得电子生成氮气,氨气失电子生成氮气,所以a电极上通入的是NO2,
故答案为:NO2;e为精铝,发生还原反应,所以d极发生氧化反应,则a极为正极,正极上二氧化氮得电子生成氮气;
(3)①a.该反应是恒压,所以无论反应是否达到平衡状态压强都不变,所以不能据此判断平衡状态,故a错误;
b.反应前后气体总质量不变但容器体积改变,所以混合气体的密度改变,当混合气体密度不变时该反应达到平衡状态,故b正确;
c.3v正(N2)=v逆(H2)时该反应达到平衡状态,当v正(N2)=3v逆(H2)时该反应没有达到平衡状态,故c错误;
d.反应前后混合气体质量不变,但气体总物质的量减小,所以混合气体相对分子质量增加,当混合气体的平均相对分子质量不再发生变化时,正逆反应速率相等,反应达到平衡状态,故d正确;
故选bd;
②相同压强下,升高温度平衡逆向移动,氨气的体积分数减小,根据图知,温度T1<T2<T3,温度越高化学平衡常数越小,所以化学平衡常数K1>K2>K3,
故答案为:K1>K2>K3;
③若体系在T2、60MPa下达到平衡,相同温度下,气体的体积分数等于其物质的量分数,
设平衡时n(NH3)=xmol,
N2(g)+3H2(g)?2NH3(g)
开始(mol)9 23 0
反应(mol)0.5x 1.5x x
平衡(mol)9-0.5x 23-1.5x x
平衡时氨气体积分数=$\frac{x}{9-0.5x+23-1.5x+x}$×100%=60%,
x=12,
氮气分压=$\frac{9-0.5×12}{9+23-12}$×60MPa=9MPa;
氨气的分压=60%×60MPa=36MPa,
氢气分压=60MPa-9MPa-36MPa=15MPa,
此时的平衡常数Kp=$\frac{(36MPa)^{2}}{(9MPa).(15MPa)^{3}}$=0.043(MPa)-2,
故答案为:9;0.043(MPa)-2.
点评 本题考查较综合,涉及化学平衡计算、化学平衡状态判断、原电池和电解池原理等知识点,侧重考查学生图象分析、计算能力,注意(3)①为恒压条件下时容器体积改变,为易错点.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案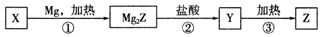
其中X为Z的氧化物;Y为氢化物,分子结构与甲烷相似.下列说法错误的是( )
| A. | X可以和氢氟酸反应 | |
| B. | 甲烷的稳定性比Y强 | |
| C. | Z是将太阳能转换为电能的常用材料 | |
| D. | 上述①②③变化过程中,依次发生置换反应、复分解反应和分解反应 |
| A. | 在化学反应中,化学能只可以转化为热能 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 已知2H2(g)+O2(g)=2H2O(l)△H<0,当反应达平衡后升高温度,反应逆向移动,逆反应速率增大,正反应速率减小 | |
| D. | 合成氨反应N2+3H2?2NH3,当N2、H2、NH3浓度相等时该反应达到了最大限度 |
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-483.6kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-241.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-241.8kJ/mol |
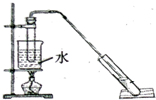 “酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:
“酒是陈的香”,是因为酒在储存过程中生成了有香味的乙酸乙酯.某兴趣小组用无水乙醇和冰醋酸制备乙酸乙酯,相关物质的数据如下:| 物质 | 乙醇 | 乙酸 | 乙酸乙酯 |
| 分子量 | 46 | 60 | 88 |
| 沸点(℃) | 78.5 | 117.9 | 77.1 |
| 密度(g/cm3) | 0.789 | 1.05 | 0.90 |
①在试管里加入3mL乙醇;然后一边摇动,一边慢慢
加入2mL浓硫酸和2mL冰醋酸.再加入少量沸石.
②按照图示连接装置,水浴加热,使蒸气经导管通到饱和碳酸钠溶液的液面上.
③待小试管中收集约3mL产物时停止加热,撤出小试管并用力振荡,然后静置待其分层.
④分离出纯净的乙酸乙酯2.3mL.
(1)实验室制备乙酸乙酯的化学方程式为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O
该反应的类型为取代反应;浓硫酸在此反应中的作用是催化剂和吸水剂.
(2)步骤①中加入沸石的目的是防止暴沸;步骤②采用水浴的优点是受热均匀.长导管的作用是冷凝回流.
(3)步骤③中饱和碳酸钠的作用是BD
A、中和乙酸和乙醇
B、中和乙酸并吸收部分乙醇
C、加速酯的生成,提高酯的产率
D、乙酸乙酯在饱和碳酸钠溶液中的溶解度比在水中更小,有利于分层析出.
(4)步骤④中需要用到的关键仪器是分液漏斗,乙酸乙酯应该从该仪器的上部流出(选择)
A、下部流出 B、上部流出 C、都可以
(5)计算可得乙酸乙酯的产率为67.2%(产率=实际产量/理论产量,保留三位有效数字)
(6)随着科技水平的提高,工业上生产乙酸乙酯时产率可能会不断提高.请问产率是否有可能达到100%不能(填“有可能”或“不可能”),理由是该反应是可逆反应,反应物不可能完全转化成生成物.
| A. | 物质的量 | B. | 物质的量浓度 | C. | 质量分数 | D. | 摩尔质量 |
①N2(g)+O2(g)??2NO(g) K1=1×10-30
②2H2(g)+O2(g)?2H2O(g) K2=2×1081
③2CO2(g)?2CO(g)+O2(g) K3=4×10-92
下列说法正确的是( )
| A. | NO分解反应NO(g)?$\frac{1}{2}$N2(g)+$\frac{1}{2}$O2(g)的平衡常数为1×10-30 | |
| B. | 根据K2的值可以判断常温下H2和O2很容易反应生成H2O | |
| C. | 常温下,NO、H2O、CO2三种物质分解放出O2的倾向顺序为NO>H2O>CO2 | |
| D. | 温度升高,上述三个反应的平衡常数均增大 |