题目内容
1.(1)铁元素能形成多种配合物,如:Fe(CO)x①基态Fe3+的M层电子排布式为3s23p63d5.
②配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x=5.常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于分子晶体(填晶体类型).
(2)氨分子中氮原子的杂化类型是sp3,如图1氨水中四种氢键哪一种是最主要的D.
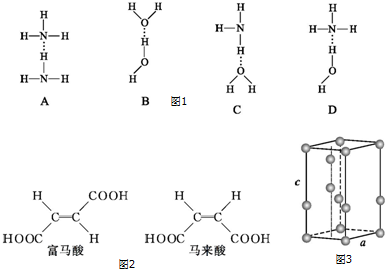
(3)试分析如图2富马酸的K2大于其顺式异构体马来酸的K2,原因是马来酸分子中酸性氢原子参与形成分子内氢键,其酸性减弱.
(4)常压下,水冷却至0℃以下,即可结晶成六方晶系的冰.日常生活中见到的冰、霜和雪等都是属于这种结构,其晶胞如图3所示(只显示氧原子,略去氢原子),晶胞参数侧棱c=737pm,菱形底边a=452pm,底面菱形的锐角是60°.(sin60°=0.865)
回答下列问题:
①计算每个晶胞中含有4个水分子.
②计算冰的密度ρ=ρ=0.917 g•cm-3.
分析 (1)①Fe原子核外电子数为26,原子形成阳离子先按能层高低失去电子,能层越高的电子越容易失去,同一能层中按能级高低失去电子,能级越高越容易失去;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,据此判断x值;分子晶体的熔沸点较低;
(2)NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3;氨水中的氢键主要是氨气分子中氮原子和水分子中氢原子间的氢键;
(3)酸性氢原子参与形成氢键时,其酸性减弱;
(4)①根据晶胞中各位置,利用均摊法计算;
②根据ρ=$\frac{m}{v}$计算.
解答 解:(1)①Fe原子核外有26个电子,核外电子排布为1s22s22p63s23p63d64s2,Fe原子失去4s能级2个电子、3d能级1个电子形成Fe3+,Fe3+电子排布式为1s22s22p63s23p63d5,则M层电子排布式为:3s23p63d5,
故答案为:3s23p63d5;
②配合物Fe(CO)x的中心原子是铁原子,其价电子数是8,每个配体提供的电子数是2,8+2x=18,x=5,分子晶体的熔沸点较低,根据题给信息知,该物质的熔沸点较低,所以为分子晶体,
故答案为:5;分子晶体;
(2)NH3中只含有单键为σ键,分子中N原子含有3个σ键电子对和1个孤电子对,杂化类型为sp3,氨水中的氢键主要是氨气分子中氮原子和水分子中氢原子间的氢键,即D选项表示的氢键,
故答案为:sp3;D;
(3)马来酸属于顺式结构,羧基上与氧原子相连的氢原子和氧原子间形成氢键,导致氢原子不易电离,酸性减弱;
故答案为:马来酸分子中酸性氢原子参与形成分子内氢键,其酸性减弱;
(4):①冰晶胞中顶点有8个分子,棱上有4个分子,体内有2个分子,晶胞中含有水分子的个数为:8×$\frac{1}{8}$+4×$\frac{1}{4}$+2=4,晶胞中含有4个水分子,
故答案为:4;
②ρ=$\frac{m}{v}$=$\frac{\frac{M×4}{{N}_{A}}}{{a}^{2}•c•sin6{0}^{°}}$=$\frac{\frac{18×4}{6.02×1{0}^{23}}}{45{2}^{2}×737×0.866×(1{0}^{-10})^{3}}$=0.917 g•cm-3
故答案为:0.917.
点评 本题考查物质结构和性质,涉及核外电子排布、价层电子对互斥理论、晶体性质等知识点,这些是学习难点,也是考查重点,难度中等.

 状元坊全程突破导练测系列答案
状元坊全程突破导练测系列答案| A. | Li、Be、B原子最外层电子数依次增多 | |
| B. | N、O、F电负性依次增大 | |
| C. | P、S、Cl元素最高正价依次升高 | |
| D. | Na、K、Rb第一电离能逐渐增大 |
| A. | CO | B. | CaF2 | C. | CH4 | D. | NH4Cl |
| A. | d元素的非金属性最强 | |
| B. | 它们均存在两种或两种以上的氧化物 | |
| C. | a的最高价氧化物对应的水化物是强碱 | |
| D. | b、c、d的气态氢化物的稳定性:b>c>d |
| A. | 二氧化碳的电子式: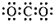 | B. | 铝离子的结构示意图: | ||
| C. | 次氯酸的结构式:H-O-Cl | D. | 质量数为18的氧原子:${\;}_{6}^{18}$O |
| A. | 已知H+(aq)+OH-(aq)═H20(l)△H=-57.3kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=-2×(-57.3)kJ•mol-1 | |
| B. | 由4P(s,红磷)═P4(s,白磷)△H=+139.2kJ/mol可知,红磷比白磷稳定 | |
| C. | H2(g)的燃烧热是285.8kJ•mol-1,则2H2O═2H2(g)+O2(g)△H=+571.6KJ•mol-1 | |
| D. | 恒温恒容时,将2molA和1molB投入密闭容器中,发生反应:2A(g)+B(g)?2C(g).充分反应后测得放出的热量为QkJ,则该反应的△H=-QkJ/mol |
| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |