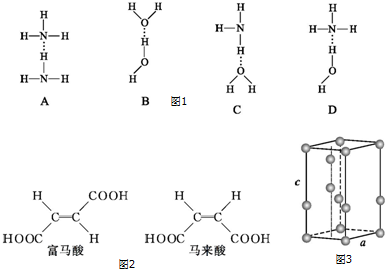
题目内容
14.NA为阿伏伽德罗常数,下列说法中正确的是( )| A. | 1 mol Cl2分别与足量的铁或氢氧化钠溶液反应,转移电子数均为2NA | |
| B. | 1molC5H12分子中共价键总数为14NA | |
| C. | 78gNa2O2固体与足量的H2O反应转移的电子数为NA | |
| D. | 标准状况下,2.24LNH3和CH4的混合气体,所含电子总数为2NA |
分析 A、氯气和铁反应时,完全做氧化剂被还原为-1价;而氯气和氢氧化钠溶液反应时,发生了自身的氧化还原反应;
B、C5H12中含12条C-H键和4条C-C键;
C、求出过氧化钠的物质的量,然后根据过氧化钠和水反应时,1mol过氧化钠转移1mol电子来分析;
D、求出混合物的物质的量,然后根据氨气和甲烷均为10电子分子来分析.
解答 解:A、氯气和铁反应时,完全做氧化剂被还原为-1价,故1mol氯气和铁反应时转移2NA个电子;而氯气和氢氧化钠溶液反应时,发生了自身的氧化还原反应,1mol氯气转移NA个电子,故A错误;
B、C5H12中含12条C-H键和4条C-C键,故1molC5H12中含16NA条共价键,故B错误;
C、78g过氧化钠的物质的量为1mol,而过氧化钠和水反应时,1mol过氧化钠转移1mol电子,故转移NA个电子,故C正确;
D、标况下2.24L氨气和甲烷的混合气体的物质的量为0.1mol,而氨气和甲烷均为10电子分子,故0.1mol混合气体中含NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
5.氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得.
(1)氨气的发生装置可以选择如图1中的A或B,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→d→c→f→e→i(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是氨水不稳定受热易分解生成氨气和水,导致溶液碱性减弱,则溶液颜色变浅.
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度增大(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案不合理(填“合理”或“不合理”),请分析:根据上述实验,加热煮沸无法除去溶液A中混有的过量氯化氢.改进方案:向含碳酸钠的氯化钠溶液中边逐滴加盐酸,边测定溶液的pH,至溶液呈中性即可(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.

(1)氨气的发生装置可以选择如图1中的A或B,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O或NH3•H2O$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O.
(2)欲收集一瓶干燥的氨气,选择如图中的装置,其连接顺序为:发生装置→d→c→f→e→i(按气流方向,用小写字母表示).
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如表实验(填写表中空白):
| 实验操作 | 实验现象及结论 |
| 将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
| 将浸有酚酞溶液的滤纸湿润后,放入盛有干操氨气的集气瓶中 | 滤纸变红,说明氨气遇水形成溶液呈碱性 |
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化.为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①>②,则稀盐酸经加热煮沸后浓度增大(填“增大”、“减小”或“不变”).为除去氯化钠溶液中的碳酸钠,小林设计了如图2方案:
你认为上述方案不合理(填“合理”或“不合理”),请分析:根据上述实验,加热煮沸无法除去溶液A中混有的过量氯化氢.改进方案:向含碳酸钠的氯化钠溶液中边逐滴加盐酸,边测定溶液的pH,至溶液呈中性即可(如合理,说明原因;如不合理,说明原因并设计改进方案).
(6)为研究氨气的还原性,小兰做了一下实验:
将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度如图3所示装置进行实验.
| 操作步骤 | 实验现象 | 解释原因 |
| 打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中红棕色气体慢慢变浅,最后褪为无色 | ②反应的化学方程式 8NH3+6NO2 $\frac{\underline{\;催化剂\;}}{\;}$7N2+12H2O |
| 将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
| 打开K2 | ③Z中的NaOH溶液倒吸入Y管中 | ④该反应是气体体积减小的反应,Y管内压强降低,在大气压的作用下发生倒吸 |
2.X元素最高氧化物对应的水化物的某种存在形态为H2X2O7,则X对应的气态氢化物为( )
| A. | XH4 | B. | XH3 | C. | H2X | D. | HX |
9.类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中,你认为正确的是( )
| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | 因为N元素的非金属性比P元素强,所以HNO3的酸性强于H3PO4 |
19.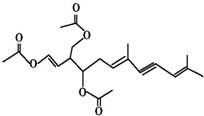 绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
 绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )
绿藻的胶质中分离出一种有机化合物(用A表示),结构如图所示,A对人体无害,可用于新鲜食品中对脂肪酶进行抑制来保持风味,也可外用使伤口快速愈合.则关于该物质的说法中错误的有( )| A. | 该物质的化学式为C21H26O6 | |
| B. | 该物质中含有两个手性碳原子 | |
| C. | 1 mol 该物质最多能消耗5 mol H2和3 mol NaOH | |
| D. | 该物质能发生加成反应、取代反应、氧化反应 |
6.化学反应处于平衡状态时,下列说法正确的是( )
| A. | 反应不再进行 | B. | 反应物浓度等于生成物浓度 | ||
| C. | 正反应速率不等于逆反应速率 | D. | 各组分浓度不再随时间而变化 |
3.下列说法错误的是( )
| A. | 胶体粒子能透过滤纸,但不能透过半透膜 | |
| B. | 胶体和溶液的本质区别在于分散质粒子大小 | |
| C. | 蛋清、豆浆、墨水都是胶体 | |
| D. | 丁达尔效应是化学变化 |
4.下列各组混合物中,无论以何种比例混合,取n mol使之充分燃烧,耗氧量为定值的是( )
| A. | CH4、C2H6 | B. | C2H4、C3H6 | C. | C2H4、C2H4O | D. | C4H8、C6H12O6 |