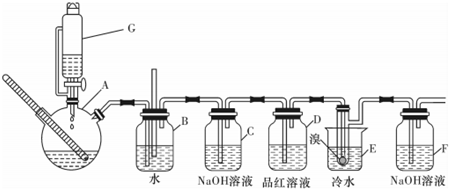
题目内容
据报道用Mg与石墨作电极与NH4Cl溶液形成原电池(盐桥为装有琼胶的饱和KCl溶液),也可生成NH3.下列说法正确是( )
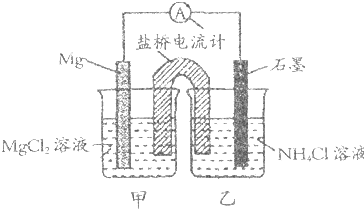

| A、石墨电极反应式为2NH4++2e-=2NH3↑+H2↑ |
| B、乙烧杯中一直存在:c(Cl-)<c(NH4+) |
| C、电子流向是由石墨→导线→Mg |
| D、盐桥中的Cl-移向乙烧杯 |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:依据原电池的原理结合电池反应,正极反应是得到电子发生还原反应的电极反应,是铵根离子得到电子的反应,据此解答即可.
解答:
解:A、反应的总反应式为Mg+2NH4Cl=MgCl2+2NH3↑+H2↑,则2NH4+在正极(石墨)上得电子生成NH3和H2,发生还原反应电极反应式为:2NH4++2e-=2NH3↑+H2↑,故A正确;
B、乙烧杯中由于铵根放电,故铵根浓度随着反应进行,逐渐减小,故说法一直存在:c(Cl-)<c(NH4+)错误,故B错误;
C、此装置为原电池,原电池中电子由负极流向正极,即从Mg经导线流向石墨,故C错误;
D、溶液中的阴离子流向负极,故盐桥中的氯离子经溶液流向甲烧杯,故D错误,
故选A.
B、乙烧杯中由于铵根放电,故铵根浓度随着反应进行,逐渐减小,故说法一直存在:c(Cl-)<c(NH4+)错误,故B错误;
C、此装置为原电池,原电池中电子由负极流向正极,即从Mg经导线流向石墨,故C错误;
D、溶液中的阴离子流向负极,故盐桥中的氯离子经溶液流向甲烧杯,故D错误,
故选A.
点评:本题主要考查的是原电池原理,依据题给信息得出电极反应式是解决本题的关键,牵涉电子流动方向分析、溶液中阴阳离子流动方向分析,综合性较强.

练习册系列答案
 教材全解字词句篇系列答案
教材全解字词句篇系列答案
相关题目
“纳米材料”是粒子直径为1~100nm(纳米)的材料,纳米碳就是其中的一种.若将纳米碳均匀地分散到蒸馏水中,所形成的物质( )①是溶液 ②是胶体 ③能透过滤纸 ④不能透过滤纸 ⑤能产生丁达尔效应 ⑥静置后,会析出黑色沉淀.
| A、①④⑥ | B、②③④ |
| C、②③⑤ | D、①③④⑥ |
下列关于铜、铝、铁的说法,正确的是( )
| A、三种金属常温下均不溶于足量的浓硝酸中 |
| B、三种金属久置于潮湿的空气中均能生成氧化物而生锈 |
| C、三种金属均能与硫反应,分别生成Cu2S、Al2S3、FeS |
| D、三种金属的还原性:Al>Fe>Cu;离子的氧化性:Cu2+>Fe3+>Al3+ |
下列实验装置(固定装置略去)和操作正确的是( )

| A、①③ | B、②④ | C、①④ | D、②③ |
下列实验操作或有关叙述正确的是( )
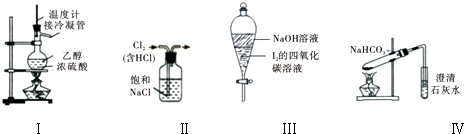

| A、用装置Ⅰ在实验室制备少量乙烯 |
| B、用装置Ⅱ来除去氯气中含有的HCl气体 |
| C、装置Ⅲ中,充分振荡后静置,下层溶液颜色保持不变 |
| D、用装置Ⅳ来探究NaHCO3的热稳定性 |
常温下,下列溶液中的粒子浓度关系正确的是( )
| A、0.2mol?L-1HF溶液与0.1mol?L-1NaOH溶液等体积混合:2c(H+)-2c(OH-)=c(F-)-c(HF) |
| B、0.1mol?L-1KHCO3溶液中:c(CO32-)+c(OH-)=c(H+)+2c(H2CO3) |
| C、pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH+)>c(OH-)=c(H+) |
| D、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |