题目内容
20.已知乙酸与乙酸乙酯的混合物中含氢的质量分数为7%,则含O的质量分数是( )| A. | 42% | B. | 44% | C. | 51% | D. | 91.9% |
分析 乙酸乙酯为C4H8O2,乙酸为C2H4O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,根据氢元素的质量分数计算混合物中碳元素质量分数,进而计算氧元素质量分数.
解答 解:乙酸乙酯为C4H8O2,乙酸为C2H4O2,各分子中碳原子与氢原子数目之比为1:2,故混合物中碳元素与氢元素的质量之比为12:2=6:1,混合物中氢元素的质量分数为7%,则混合物中碳元素的质量分数为7%×6=42%,故混合物中氧元素质量分数=1-7%-42%=51%,故选C.
点评 本题考查混合物中元素的质量分数的计算,关键是根据各成分的化学式得出C、H的固定组成,学生应学会利用定组成的方法来解答混合物中元素的质量分数计算.

练习册系列答案
相关题目
17.关于苯分子的说法正确的是( )
| A. | 分子中共含有6个极性键 | B. | 分子中不含非极性键 | ||
| C. | 分子中只含σ键 | D. | 分子中含有π键 |
15.学习化学要准确掌握化学基本概念和研究方法.按要求回答下列问题:
(1)下列是某同学对有关物质进行分类的列表:
找出上述三组分类中的错误,错误物质的化学式为Na2CO3、Al2O3.
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
该变化的基本反应类型是分解反应,Q物质的作用为催化剂.
(1)下列是某同学对有关物质进行分类的列表:
| 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
| 第一组 | Na2CO3 | H2SO4 | NaHCO3 | CaO | CO2 |
| 第二组 | NaOH | HCl | NaCl | Na2O | SO3 |
| 第三组 | NaOH | CH3COOH | CaF2 | Al2O3 | SO2 |
(2)下列2个反应,按要求填写相关量.
①2Na2O2+2H2O=4NaOH+O2反应中,每消耗lmol Na2O2生成16g O2;
②除去NaCl溶液中少量的Na2SO4杂质,要判断所加BaCl2溶液是否过量,可向滤液中加入X溶液.X可以是D(填代号)
A.NaOH B.AgNO3 C.HCI D.Na2SO4
(3)配平下面化学方程式,回答下列问题:
3C+K2Cr2O7+8H2SO4=2K2SO4+3CO2↑+2Cr2(SO4)3+8H2O
①H2SO4在上述反应中表现出来的性质是(填选项编号)C.
A.氧化性. B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为4.48L.
(4)在一个密闭容器中放人M、N、Q、P四种物质,在一定条件下发生化学反应,一段时间后,测得有关数据如表,按要求回答下列问题:
| 物质 | M | N | Q | P |
| 反应前质量(g) | 50 | 1 | 3 | 12 |
| 反应后质量(g) | X | 26 | 3 | 30 |
5.在能使PH试纸变红的溶液中,下列离子因发生了氧化还原反应而不能大量共存的是( )
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
①Ag+Na+Al3+Cl-
②Na+Fe2+Cl-NO3-
③K+Mg2+S2- SO42-
④K+H+SO42-SO32-
⑤Na+NO3-SO42-I-.
| A. | ②⑤ | B. | ①②④ | C. | ②③⑤ | D. | 全部 |
12.20世纪20年代起,就有人预言可能存在由4个氧原子构成的氧分子,但一直没有得到证实.最近,意大利一所大学的科学家使用普通氧分子和带正电的氧离子制造出了这种新型氧分子,并用质谱仪探测到了它存在的证据.若该氧分子具有空间对称结构,你认为该氧分子是( )
| A. | 氧元素的一种同位素 | B. | 氧元素组成的一种新单质 | ||
| C. | 一种新的氧化物 | D. | 可能含极性键和非极性键 |
9.下列叙述正确的是( )
| A. | 氯水中:2c(Cl2)=c(ClO-)+c(Cl-)+c(HClO) | |
| B. | 水的离子积常数Kw 随着温度的升高而增大,说明水的电离是放热反应 | |
| C. | 醋酸溶液的pH=a,将此溶液稀释10倍后,溶液的pH=b,则b<a+1 | |
| D. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(Na+)最小的是Na2CO3 |
10.我国湘黔渝三地交界地区是中国电解锰企业最集中的地区,被称为中国的“锰三角”.金属锰的熔点很高,常用铝热法制得粗锰,再用电解法制得纯的金属锰.铝被用于冶炼金属锰,是因为铝( )
| A. | 熔点低 | B. | 具有还原性 | ||
| C. | 具有两性 | D. | 冶炼反应中放出大量的热 |
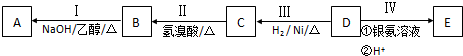
 ;
; ;
; 和
和 .
.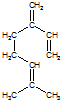 ,也可简写为
,也可简写为 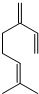 ,其分子式是C10H16,可以发生的化学反应有①④(选填序号).
,其分子式是C10H16,可以发生的化学反应有①④(选填序号).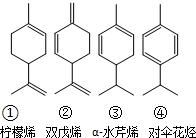
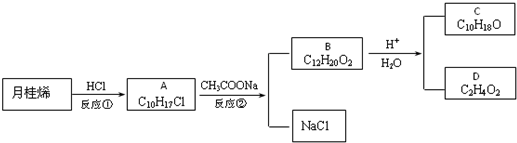
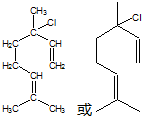 .
. .
.