题目内容
下列离子方程式书写正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.混合后溶液呈中性,反应生成硫酸钡、硫酸钠和水;
B.氯气的物质的量为
=0.005mol,溴化亚铁的物质的量为0.01mol,由电子守恒及优先氧化可知,只有亚铁离子被氧化;
C.电解生成氢气、氯气、氢氧化镁;
D.石灰水完全反应,生成碳酸钙、碳酸钠和水.
B.氯气的物质的量为
| 0.112L |
| 22.4L/mol |
C.电解生成氢气、氯气、氢氧化镁;
D.石灰水完全反应,生成碳酸钙、碳酸钠和水.
解答:
解:A.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性的离子反应为2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A正确;
B.将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.用惰性电极电解饱和MgCl2溶液的离子反应为Mg2++2Cl-+2H2O
Cl2↑+H2↑+Mg(OH)2↓,故C错误;
D.向澄清石灰水中加入过量的碳酸氢钠溶液的离子反应为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D错误;
故选A.
B.将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中的离子反应为2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.用惰性电极电解饱和MgCl2溶液的离子反应为Mg2++2Cl-+2H2O
| ||
D.向澄清石灰水中加入过量的碳酸氢钠溶液的离子反应为Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D错误;
故选A.
点评:本题考查离子反应的书写的正误判断,为高考常见题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重与量有关的离子反应、电解、氧化还原反应的离子反应考查,选项B为解答的难点,题目难度不大.

练习册系列答案
相关题目
下列离子方程式书写正确的是( )
A、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
| C、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
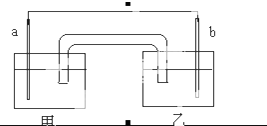 某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是( )
某化学兴趣小组设计如图原电池:其中a、b分别为Cu和Ag,甲和乙分别是氨水和硝酸银溶液,盐桥的琼脂中吸附有KCl溶液,反应一段时间后,下列说法正确的是( )| A、b为负极,电极方程式为:Ag++e-═Ag |
| B、甲中出现大量蓝色沉淀 |
| C、总反应为:Cu+2Ag+═Cu2++Ag |
| D、反应时,盐桥中的K+向乙方向移动 |
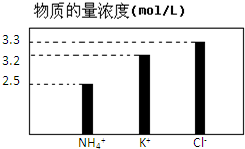 在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )
在无土栽培中,需配置20L含NH4Cl、KCl和K2CO3的营养液.营养液中部分离子的物质的量浓度如图所示.若用KCl、NH4Cl和(NH4)2CO3三种固体为原料来配制上述营养液,则需KCl、NH4Cl和(NH4)2CO3三种固体得物质的量依次为(单位为mol)( )| A、2、64、24 |
| B、16、50、24 |
| C、32、50、12 |
| D、64、2、24 |
下列化学反应所对应的离子方程式正确的是( )
| A、金属铝和过量的氢氧化钠溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| C、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
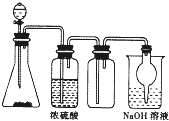 如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )
如图是一套实验室制取气体装置,用于发生、干燥、收集和吸收有毒气体,下列各实验能利用这套装置进行的是( )| A、MnO2和浓盐酸制氯气 |
| B、锌粒和稀硫酸制氢气 |
| C、铜片和浓硝酸制二氧化氮 |
| D、浓氨水和生石灰制氨气 |
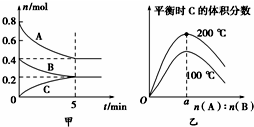 在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )
在2L的密闭容器中发生反应xA(g)+yB(g)?zC(g).图甲表示200℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A):n(B)的变化关系.则下列结论正确的是( )| A、200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol?L-1?min-1 |
| B、200℃时,该反应的平衡常数为25 L2/mol2 |
| C、当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大 |
| D、由图乙可知,反应xA(g)+yB(g)?zC(g)的△H<0,且a=2 |
 2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因.
2013年9月,中国华北华中地区发生了严重的雾霆天气,北京、河北、河南等地的空气污染升为6级空气污染,属于重度污染.汽车尾气、燃煤废气、冬季取暖排放的CO2等都是雾霆形成的原因. 分子中含氧官能团的名称是
分子中含氧官能团的名称是