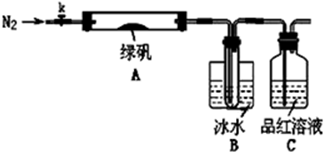
题目内容
下列化学反应所对应的离子方程式正确的是( )
| A、金属铝和过量的氢氧化钠溶液反应:2OH-+Al═AlO2-+H2↑ |
| B、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| C、稀硫酸与氢氧化钡溶液反应:H++OH-═H2O |
| D、向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.漏写反应物水,电子、电荷不守恒;
B.反应生成氯化亚铁;
C.漏写生成硫酸钡的离子反应;
D.反应生成氢氧化铝和碳酸氢钠.
B.反应生成氯化亚铁;
C.漏写生成硫酸钡的离子反应;
D.反应生成氢氧化铝和碳酸氢钠.
解答:
解:A.金属铝和过量的氢氧化钠溶液反应的离子反应为2H2O+2OH-+2Al═2AlO2-+3H2↑,故A错误;
B.氯化铁溶液中加入铁粉的离子反应为2Fe3++Fe═3Fe2+,故B正确;
C.硫酸与氢氧化钡溶液反应的离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,故C错误;
D.向NaAlO2溶液中通入过量CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选B.
B.氯化铁溶液中加入铁粉的离子反应为2Fe3++Fe═3Fe2+,故B正确;
C.硫酸与氢氧化钡溶液反应的离子反应为Ba2++SO42-+2H++2OH-═2H2O+BaSO4↓,故C错误;
D.向NaAlO2溶液中通入过量CO2的离子反应为AlO2-+CO2+2H2O═Al(OH)3↓+HCO3-,故D错误;
故选B.
点评:本题考查离子反应的书写的正误判断,为高考常见题型,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
根据如图,下列判断中正确的是( )
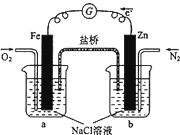

| A、烧杯a中发生反应O2+4H++4e═ˉ2H2O,溶液pH降低 |
| B、烧杯b中发生反应为2Zn-4eˉ═2Zn2+ |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
下列定量仪器读数正确的是( )
A、 8.0mL |
B、 24.00g |
C、 23.65mL |
D、 38.2℃ |
下列叙述正确的是( )
| A、向0.1 mol/L醋酸溶液中加入少量醋酸钠溶液,溶液的pH增大 |
| B、向0.1 mol/L醋酸溶液中加入少量NaOH溶液,溶液中c(CH3COO-)减少 |
| C、向0.1 mol/L醋酸溶液中不断加水,溶液中c(H+)增大 |
| D、向0.1 mol/L醋酸溶液中滴入少量浓盐酸,溶液的导电性减弱 |
下列叙述正确的是( )
| A、溶液和胶体的本质区别是有无丁达尔效应 |
| B、常用的危险化学品酒精和甲烷的标志都是易燃液体 |
| C、氧化钠和过氧化钠中氧元素的化合价都是-2价 |
| D、由同种分子构成的物质一定是纯净物 |
下列离子方程式书写正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |