��Ŀ����
 2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ��
2013��9�£��й��������е������������ص������������������ӱ������ϵȵصĿ�����Ⱦ��Ϊ6��������Ⱦ�������ض���Ⱦ������β����ȼú����������ȡů�ŷŵ�CO2�ȶ��������γɵ�ԭ����1������β����������Ҫԭ��Ϊ��2NO��g��+2CO��g��
| ���� |
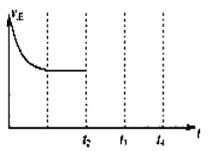
�����жϸ÷�Ӧ�ﵽƽ��״̬�ı�־��
A���ڵ�λʱ��������1mol CO2��ͬʱ������1mol CO
B�����������ܶȲ��ٸı�
C����������ƽ����Է����������ٸı�
D����������ѹǿ���ٱ仯
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2�����������������������£�t3ʱ�̴ﵽ�µ�ƽ��״̬��֮���ٸı�������������ͼ�в��仭����t2��t4ʱ������Ӧ������ʱ��ı仯���ߣ�
��2���ı�ú�����÷�ʽ�ɼ��ٻ�����Ⱦ��ͨ���ɽ�ˮ����ͨ�����ȵ�̼�õ�ˮú�����䷴ӦΪ��
C��s��+H2O��g��?CO��g��+H2��g����H=+131.3?mol-1
�ٸ÷�Ӧ��
��ú���������в������к�����H2S����������Na2C03��Һ���գ��÷�Ӧ�����ӷ���ʽΪ
��3����֪��Ӧ��CO��g��+H2O��g���TCO2��g��+H2��g�����ֽ���ͬ����CO��g����H20��g���ֱ�ͨ�뵽���Ϊ2L�ĺ����ܱ������н��з�Ӧ���õ������������ݣ�
| ʵ���� | �¶� �� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | ||
| CO | H2O | H2 | CO | |||
| 1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
| 2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
��ʵ��3�У���ƽ��ʱ��CO��ת���ʴ���ˮ��������a��b��������Ĺ�ϵ��
�۸÷�Ӧ�ġ�H
���㣺��ѧƽ��ļ���,��ѧƽ���Ӱ������,��ѧƽ��״̬���ж�
ר�⣺��ѧƽ��ר��
��������1���ٻ�ѧ��Ӧ�ﵽ��ѧƽ��״̬ʱ�����淴Ӧ������ȣ��Ҳ�����0�������ʵ�Ũ�Ȳ��ٷ����仯���ɴ�������һЩ�������������仯���Դ˽����жϣ��ó���ȷ���ۣ�
�ڼ�Сѹǿ�����淴Ӧ���ʼ�С��ƽ�����������������ķ����ƶ���
��2�������ݷ�Ӧ�Է����е��ж����ݡ�H-T��S��0�����жϣ�
�ڸ���̼������������������ƽ�ⳣ�����бȽ���������̼�ᡢ̼����������������Դ�С���Ӷ��ó���Ӧ���д����Ӧ�����ӷ���ʽ��
��3��������ͼ��������ʽ����ƽ��Ũ�ȣ���ϻ�ѧƽ�ⳣ��������㣻
������CO��H2�Ļ�ѧ��������ȶ�Ϊ1�����Ե��������ʵ������ʱ����ת������ȣ�ҪʹCOת���ʴ���H2��ת���ʣ�������H2�����ʵ�����
�۵ڶ����¶ȱȵ�һ��ߣ���Ӧ�����ʵ����ȵ�һ����룬����ƽ��ʱH2�����ʵ����ȵ�һ���һ���٣������÷�ӦΪ���ȷ�Ӧ����ͬһ��Ӧ�¶���ͬ��ƽ�ⳣ����ͬ�����ݱ���ʵ��2����900��ʱƽ�ⳣ�����ټ���ʵ��3Ũ���̣���ƽ�ⳣ������ж�ƽ���ƶ����ݴ˽��
�ڼ�Сѹǿ�����淴Ӧ���ʼ�С��ƽ�����������������ķ����ƶ���
��2�������ݷ�Ӧ�Է����е��ж����ݡ�H-T��S��0�����жϣ�
�ڸ���̼������������������ƽ�ⳣ�����бȽ���������̼�ᡢ̼����������������Դ�С���Ӷ��ó���Ӧ���д����Ӧ�����ӷ���ʽ��
��3��������ͼ��������ʽ����ƽ��Ũ�ȣ���ϻ�ѧƽ�ⳣ��������㣻
������CO��H2�Ļ�ѧ��������ȶ�Ϊ1�����Ե��������ʵ������ʱ����ת������ȣ�ҪʹCOת���ʴ���H2��ת���ʣ�������H2�����ʵ�����
�۵ڶ����¶ȱȵ�һ��ߣ���Ӧ�����ʵ����ȵ�һ����룬����ƽ��ʱH2�����ʵ����ȵ�һ���һ���٣������÷�ӦΪ���ȷ�Ӧ����ͬһ��Ӧ�¶���ͬ��ƽ�ⳣ����ͬ�����ݱ���ʵ��2����900��ʱƽ�ⳣ�����ټ���ʵ��3Ũ���̣���ƽ�ⳣ������ж�ƽ���ƶ����ݴ˽��
���
�⣺��1����A���ڵ�λʱ��������1mol CO2������Ӧ��ͬʱ������1mol COҲ������Ӧ����A����
B���ܶ�=
�����������䣬���Ҳ���䣬�ʻ��������ܶȲ��ٸı䲻����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���B����
C��ƽ��������=
�����������䣬�����ʵ�����䣬�ʻ�������ƽ����Է����������ٸı����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���C��ȷ��
D����Ӧǰ�������������ȣ��ʻ�������ѹǿ���ٱ仯����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���D��ȷ��
�ʴ�Ϊ��CD��
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2���������淴Ӧ���ʾ��Ǽ�С�ģ���ƽ�����淴Ӧ�����ƶ���������ȷ��ͼ��Ӧ����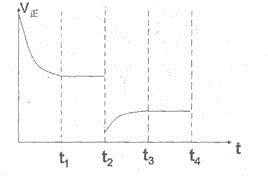 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
��2����C��s��+H2O��g��?CO��g��+H2��g����H=+131.3?mol-1����Ӧ�ʱ��H��0��S��0����H-T��S�����£���H-T��S��0�������Է����У�
�ʴ�Ϊ�����£�
������Ka2=5.61��10-11��Ka1=9.1��10-8��Ka1=4.30��10-7��Ka2=5.61��10-11��Ka2=1.1��10-12�������������ܹ���̼������Һ��Ӧ����̼�����ƺ����⻯�ƣ���Ӧ�����ӷ���ʽΪ��CO32-+H2S=HCO3-+HS-��
�ʴ�Ϊ��CO32-+H2S=HCO3-+HS-��
��3����H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼŨ�� 1mol/L 2mol/L 0 0
ת��Ũ�� 0.8mol/L 0.8mol/L 0.8mol/L 0.8mol/L
ƽ��Ũ�� 0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
K=
=
=2.67��
�ʴ�Ϊ��2.67��
������CO��H2�Ļ�ѧ��������ȶ�Ϊ1�����Ե��������ʵ������ʱ����ת������ȣ�ҪʹCOת���ʴ���H2��ת���ʣ�������H2�����ʵ�������a/b ��ֵС��1��
�ʴ�Ϊ��a��b��
��ʵ��1��CO��ת����Ϊ
��100%=40%��ʵ��2��CO��ת����Ϊ
��100%=20%����ʵ��1��ת���ʴ���ʵ��2����˵���¶�����ƽ�����淴Ӧ�����ƶ�������Ӧ���ȣ��ʡ�H��0��
�ʴ�Ϊ������
B���ܶ�=
| m |
| V |
C��ƽ��������=
| m |
| n |
D����Ӧǰ�������������ȣ��ʻ�������ѹǿ���ٱ仯����Ϊ�ж��Ƿ�ﵽ��ѧƽ��״̬�����ݣ���D��ȷ��
�ʴ�Ϊ��CD��
����t2ʱ�̣����������ݻ�Ѹ������ԭ����2���������淴Ӧ���ʾ��Ǽ�С�ģ���ƽ�����淴Ӧ�����ƶ���������ȷ��ͼ��Ӧ����
 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
����2����C��s��+H2O��g��?CO��g��+H2��g����H=+131.3?mol-1����Ӧ�ʱ��H��0��S��0����H-T��S�����£���H-T��S��0�������Է����У�
�ʴ�Ϊ�����£�
������Ka2=5.61��10-11��Ka1=9.1��10-8��Ka1=4.30��10-7��Ka2=5.61��10-11��Ka2=1.1��10-12�������������ܹ���̼������Һ��Ӧ����̼�����ƺ����⻯�ƣ���Ӧ�����ӷ���ʽΪ��CO32-+H2S=HCO3-+HS-��
�ʴ�Ϊ��CO32-+H2S=HCO3-+HS-��
��3����H2O��g��+CO��g��?CO2��g��+H2��g��
��ʼŨ�� 1mol/L 2mol/L 0 0
ת��Ũ�� 0.8mol/L 0.8mol/L 0.8mol/L 0.8mol/L
ƽ��Ũ�� 0.2mol/L 1.2mol/L 0.8mol/L 0.8mol/L
K=
| c(CO2)c(H2) |
| c(H2O)c(CO) |
| 0.8��0.8 |
| 0.2��1.2 |
�ʴ�Ϊ��2.67��
������CO��H2�Ļ�ѧ��������ȶ�Ϊ1�����Ե��������ʵ������ʱ����ת������ȣ�ҪʹCOת���ʴ���H2��ת���ʣ�������H2�����ʵ�������a/b ��ֵС��1��
�ʴ�Ϊ��a��b��
��ʵ��1��CO��ת����Ϊ
| 1.6 |
| 4 |
| 0.4 |
| 2 |
�ʴ�Ϊ������
���������⿼�黯ѧƽ���Ӱ�����ط����жϣ�ƽ�ⳣ������Ӧ�ã����ص缫��Ӧ����д��������Ŀ�ѶȽϴ�ѧϰ��ע����ؽ���Ļ��ۣ�

��ϰ��ϵ�д�
 ��ʱѵ���������������ϵ�д�
��ʱѵ���������������ϵ�д�
�����Ŀ
 ���ΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ�������
���ΪԪ�����ڱ�ǰ�����ڵ�һ���֣������й�R��W��X��Y��Z����Ԫ�ص������У���ȷ���ǣ�������| A��ԭ�Ӱ뾶��X��W��Y |
| B��Y��Z�������ӵ��Ӳ�ṹ����Rԭ�ӵ���ͬ |
| C��W���⻯���X���⻯���ȶ� |
| D��YԪ�ص�����������Ӧˮ�����WԪ�ص�����������Ӧˮ���������ǿ |
�������ӷ���ʽ��д��ȷ���ǣ�������
| A��NaHSO4��Һ��Ba��OH��2��Һ��Ϻ���Һ�����ԣ�2H++SO42-+Ba2++2OH-=BaSO4��+2H2O | ||||
| B������״����112 mL����ͨ��10 mL 1 mol?L-1���廯������Һ�У�2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C���ö��Ե缫��ⱥ��MgCl2��Һ��2Cl-+2H2O
| ||||
| D�������ʯ��ˮ�м��������̼��������Һ��Ca2++OH-+HCO3-=CaCO3��+H2O |
����ʵ�����������ⶨ���ƫ�ߵ��ǣ�������
| A������֪Ũ�ȵ�����ζ�δ֪Ũ�ȵ�����������Һʱ����ȡ�ζ���ĩ����ʱ�����ӿ̶��� |
| B���ⶨ����ͭ�����нᾧˮ������ʵ��ʱ������ʱ�����δ��ȫ��� |
| C���к͵ζ�ʱ���Ӵ���Һǰ��ƿ��������ˮ |
| D���ⶨ1mol��������IJ����У���Ӧ������δ���� |

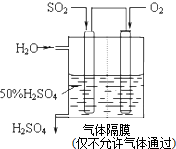
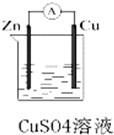 ij��ѧ��ȤС��������ͼ��ʾԭ���װ�ý���ʵ�飬��ش��������⣺
ij��ѧ��ȤС��������ͼ��ʾԭ���װ�ý���ʵ�飬��ش��������⣺