题目内容
下列离子方程式书写正确的是( )
A、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
| C、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |
考点:离子方程式的书写
专题:离子反应专题
分析:A.电解生成的氢氧根离子与镁离子反应生成难溶物氢氧化镁;
B.亚铁离子还原性大于溴离子,氯气不足时亚铁离子优先被氧化;先计算出氯气和溴化亚铁的物质的量,然后判断过量情况及反应产物;
C.溶液为中性,则硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.碳酸氢钠过量,离子方程式按照碳酸氢钠的组成书写,反应后碳酸根离子有剩余.
B.亚铁离子还原性大于溴离子,氯气不足时亚铁离子优先被氧化;先计算出氯气和溴化亚铁的物质的量,然后判断过量情况及反应产物;
C.溶液为中性,则硫酸氢钠与氢氧化钡的物质的量之比为2:1;
D.碳酸氢钠过量,离子方程式按照碳酸氢钠的组成书写,反应后碳酸根离子有剩余.
解答:
解:A.用惰性电极电解MgCl2溶液,反应生成的氢氧根离子与镁离子反应生成氢氧化镁沉淀,正确的离子反应为:Mg2++2Cl-+2H2O
Mg(OH)2↓+Cl2↑+H2↑,故A错误;
B.标准状况下112 mL氯气的物质的量为0.005mol,10 mL 1 mol?L-1的溴化亚铁溶液中含有0.01mol溴化亚铁,含有0.01mol亚铁离子、0.02mol溴离子,由于亚铁离子还原性大于溴离子,亚铁离子优先与氯气反应;0.01mol亚铁离子完全反应消耗0.005mol氯气,氯气恰好与亚铁离子反应,溴离子不参加反应,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性,硫酸氢钠与氢氧化钡按照2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C正确;
D.澄清石灰水中加入过量的碳酸氢钠溶液,反应生成碳酸钙、碳酸钠和水,正确的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D错误;
故选C.
| ||
B.标准状况下112 mL氯气的物质的量为0.005mol,10 mL 1 mol?L-1的溴化亚铁溶液中含有0.01mol溴化亚铁,含有0.01mol亚铁离子、0.02mol溴离子,由于亚铁离子还原性大于溴离子,亚铁离子优先与氯气反应;0.01mol亚铁离子完全反应消耗0.005mol氯气,氯气恰好与亚铁离子反应,溴离子不参加反应,正确的离子方程式为:2Fe2++Cl2=2Fe3++2Cl-,故B错误;
C.NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性,硫酸氢钠与氢氧化钡按照2:1反应,反应的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故C正确;
D.澄清石灰水中加入过量的碳酸氢钠溶液,反应生成碳酸钙、碳酸钠和水,正确的离子方程式为:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-,故D错误;
故选C.
点评:本题考查了离子方程式的正误判断,该题是高考中的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
相关题目
下列有关碳酸钠、碳酸氢钠的说法中,正确的是( )
| A、除去碳酸钠固体中混有的少量碳酸氢钠可以采用加热的方法 |
| B、相同条件下,碳酸钠的溶解度小于碳酸氢钠的溶解度 |
| C、碳酸钠与盐酸反应放出二氧化碳的剧烈程度强于碳酸氢钠 |
| D、石灰水能和NaHCO3反应,不与Na2CO3反应 |
下列有机物的命名正确的是( )
| A、3,3-二甲基-4-乙基戊烷 |
| B、3,3,4-三甲基-1-己烯 |
| C、3,4,4-三甲基己烷 |
| D、2,3,3-三甲基-2-庚烯 |
根据如图,下列判断中正确的是( )
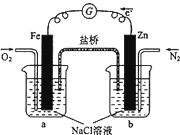

| A、烧杯a中发生反应O2+4H++4e═ˉ2H2O,溶液pH降低 |
| B、烧杯b中发生反应为2Zn-4eˉ═2Zn2+ |
| C、电子从Zn极流出,流入Fe极,经盐桥回到Zn极 |
| D、向烧杯a中加入少量K3[Fe(CN)6]溶液,有蓝色沉淀生成 |
下列各组溶液,只用试管和胶头滴管,不用任何试剂就可以鉴别的是( )
①稀H2SO4和Na2CO3 ②KOH和Al2(SO4)3 ③Ca(OH)2和NaHCO3 ④NaAlO2和稀盐酸.
①稀H2SO4和Na2CO3 ②KOH和Al2(SO4)3 ③Ca(OH)2和NaHCO3 ④NaAlO2和稀盐酸.
| A、①②④ | B、①②③ |
| C、①③④ | D、全部 |
 如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )
如表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )| A、原子半径:X>W>Y |
| B、Y、Z的阴离子电子层结构都与R原子的相同 |
| C、W的氢化物比X的氢化物稳定 |
| D、Y元素的最高价氧化物对应水化物比W元素的最高价氧化物对应水化物的酸性强 |
下列离子方程式书写正确的是( )
| A、NaHSO4溶液与Ba(OH)2溶液混合后溶液呈中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O | ||||
| B、将标准状况下112 mL氯气通入10 mL 1 mol?L-1的溴化亚铁溶液中:2Fe2++4Br-+3Cl2=2Fe3++6Cl-+2Br2 | ||||
C、用惰性电极电解饱和MgCl2溶液:2Cl-+2H2O
| ||||
| D、向澄清石灰水中加入过量的碳酸氢钠溶液:Ca2++OH-+HCO3-=CaCO3↓+H2O |



