题目内容
16.下列说法不正确的是( )| A. | 用铜作电极电解NaCl溶液,可以实现反应:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑ | |
| B. | 用铜、铝作电极与电解质溶液构成原电池时,铜一定是正极 | |
| C. | N2O4和NO2混合气体69g,完全与水反应转移电子数约为6.02×1023 | |
| D. | HCl和HS-均是含有一个极性键的18电子粒子 |
分析 A.Cu在阳极失电子生成铜离子,水电离的氢离子在阴极得电子生成氢气;
B.铜、铝作电极,浓硝酸作电解质溶液时,Al会钝化;
C.N2O4和NO2混合气体中N2O4能转化为NO2,结合反应3NO2+H2O=2HNO3+NO分析计算;
D.不同非金属原子间形成极性键,结合微粒的电子数分析.
解答 解:A.Cu在阳极失电子生成铜离子,水电离的氢离子在阴极得电子生成氢气,溶液中铜离子与氢氧根离子结合生成氢氧化铜沉淀,则用铜作电极电解NaCl溶液,可以实现反应:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑,故A正确;
B.铜、铝作电极,浓硝酸作电解质溶液时,Al会钝化,Cu失电子,Cu作负极,Al为正极,正极上硝酸根离子得电子,故B错误;
C.N2O4和NO2混合气体中N2O4能转化为NO2,69g全部转化为NO2时,其物质的量为1.5mol,反应3NO2+H2O=2HNO3+NO中3mol气体转移2mol电子,所以1.5mol气体转移1mol电子,即转移电子数约为6.02×1023,故C正确;
D.不同非金属原子间形成极性键,HCl中含有H-Cl极性键,HS-中含有H-S极性键,二者含有18电子,故D正确.
故选B.
点评 本题考查了电解原理的应用、原电池原理的应用、氧化还原反应、化学键等,题目涉及的知识点较多,题目难度中等,注意把握四氧化二氮与二氧化氮的转化以及氧化还原反应中电子转移的计算,侧重于考查学生的分析能力和计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.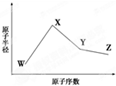 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
Ⅰ.(1)X位于元素周期表中的位置第三周期第ⅠA族;W的基态原子核外有2个未成对电子.
(2)X的单质和Y的单质相比,熔点较高的是Si(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+4H2O=H4SiO4↓+4HCl.
Ⅱ.部分化学键的键能见下表:
(1)比较下列两组物质的熔点高低(填“>”“<”)SiC>Si SiCl4< SiO2
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),计算该反应的反应热△H=+236kJ•mol-1.
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如下图所示.已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的电负性在同周期主族元素中最大.Ⅰ.(1)X位于元素周期表中的位置第三周期第ⅠA族;W的基态原子核外有2个未成对电子.
(2)X的单质和Y的单质相比,熔点较高的是Si(写化学式);Z的气态氢化物和溴化氢相比,较稳定的是HCl(写化学式).
(3)Y与Z形成的化合物和足量水反应,生成一种弱酸和一种强酸,该反应的化学方程式是SiCl4+4H2O=H4SiO4↓+4HCl.
Ⅱ.部分化学键的键能见下表:
| 化学键 | Si-O | Si-Cl | H-H | H-Cl | Si-Si | Si-C |
| 键能/ kJ•mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
(2)工业上高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)$\frac{\underline{\;高温\;}}{\;}$Si(s)+4HCl(g),计算该反应的反应热△H=+236kJ•mol-1.
7.下列说法中正确的是( )
| A. | 过氧化氢酶在重金属盐的作用下会失去活性 | |
| B. | 油脂的硬化是指含有不饱和键的油脂发生的催化加氢的反应 | |
| C. | 即使条件不同,卤代烷烃与强碱反应生成的有机物也都只有一种 | |
| D. | 有机物都是由碳、氢和氧三种元素组成的,含有碳元素的物质都是有机物 |
11.下列有关说法正确的是( )
| A. | 蛋白质、淀粉、纤维素、葡萄糖等都能在人体内水解并提供能量 | |
| B. | 将甲烷和乙烯的混合气体通过盛有溴水的洗气瓶,即可提纯甲烷 | |
| C. | C2H6与氯气发生取代反应,C2H4与HCl发生加成反应,均可得到C2H5Cl | |
| D. | 用溴水一种试剂就可将苯、CCl4、乙酸、乙醇区别 |
1.下列过程中,化学平衡不发生移动的是( )
| A. | H2、I2、HI平衡时的混合气体加压后颜色变深 | |
| B. | Na2CrO4溶液中滴加稀硫酸,溶液颜色变深 | |
| C. | 红棕色的NO2加压后颜色先变深后逐渐变浅 | |
| D. | 向氯水中加入适量石灰石,氯水的杀菌能力增强 |
5.汽车尾气中的有害物质NO和CO能缓慢起反应,2CO+2NO═N2+2CO2,为了控制大气污染,某同学提出了下列建议,你认为可行的方法是( )
| A. | 改变汽车尾气排放压强 | |
| B. | 提高反应温度 | |
| C. | 在尾气排放处使用催化剂 | |
| D. | 向汽车发动机燃烧室中通入过量的空气 |
6.把①淀粉 ②纤维素 ③油脂 ④酶 ⑤蛋白质,在酸存在的条件下分别进行水解,其水解的最终产物只有1种的有( )
| A. | ①②③ | B. | ①② | C. | ②③④ | D. | ①②④⑤ |