题目内容
7.下列说法中正确的是( )| A. | 过氧化氢酶在重金属盐的作用下会失去活性 | |
| B. | 油脂的硬化是指含有不饱和键的油脂发生的催化加氢的反应 | |
| C. | 即使条件不同,卤代烷烃与强碱反应生成的有机物也都只有一种 | |
| D. | 有机物都是由碳、氢和氧三种元素组成的,含有碳元素的物质都是有机物 |
分析 A.重金属盐能使酶发生变性;
B.油脂中油含碳碳双键;
C.条件不同,卤代烃可发生消去或水解反应;
D.有机物一定含C元素,可能含、H、O元素,但含C元素的物质不一定为有机物.
解答 解:A.重金属盐能使酶发生变性,则过氧化氢酶在重金属盐的作用下会失去活性,故A正确;
B.油脂中油含碳碳双键,不饱和键的油脂发生的催化加氢反应也称为硬化反应,故B正确;
C.条件不同,卤代烃可发生消去或水解反应,NaOH醇溶液发生消去反应时产物可能不止一种,故C错误;
D.有机物一定含C元素,可能含、H、O元素,但含C元素的物质不一定为有机物,如CO为无机物,故D错误;
故选AB.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,注意有机反应类型的判断,侧重分析与应用能力的考查,选项C为易错点,题目难度不大.

练习册系列答案
相关题目
14.下列关于硅的说法,不正确的是( )
| A. | 硅的化学性质不活泼,常温下不与任何物质反应 | |
| B. | 硅的导电性能介于金属和绝缘体之间,是良好的半导体材料 | |
| C. | 硅是非金属元素,它的单质是灰黑色有金属光泽的固体 | |
| D. | 加热到一定温度时硅能与H2、O2等非金属反应 |
15.某学生鉴定甲盐的流程如图所示,下列说法正确的是( )
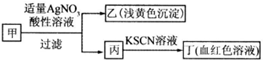

| A. | 如果甲中含有S2-,则乙是S沉淀 | |
| B. | 如果乙是AgBr沉淀,那么甲一定是FeBr3 | |
| C. | 丙中肯定含有Fe3+,所以甲是FeBr2 | |
| D. | 甲中含有铁元素,可能显示+2或者+3价 |
2.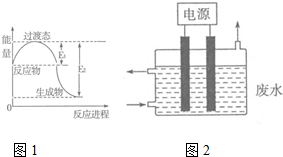 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.
(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
回答下列问题:①该反应在330s~530s的平均反应速率为$\frac{0.05×(73%-59%)}{200}$(只列算式,不做运算)
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
 氮元素的化合物种类繁多,性质也各不相同.
氮元素的化合物种类繁多,性质也各不相同.(1)图1为一定温度下1molNO2(g)和1molCO(g)反应生成NO(g)和CO2(g)过程中的能量变化示意图.已知E1=147.5kJ•mol-1,E2=376.2kJ•mol-1(E1、E2为反应的活化能).若在反应体系中加入催化剂,反应速率增大,则E1减小(填“增大”、“减小”或“不变”).该反应的热化学方程式为NO2(g)+CO(g)=NO(g)+CO2(g)△H=-228.7KJ/mol.
(2)硝基苯甲酸乙酯在OH-存在的条件下发生水解反应:
O2NC6H4COOC2H5+OH-?O2NC6H4COOO-+C2H5OH
两种反应物的初始浓度均为0.050mol•L-1,某温度下测得O2NC6H4COOC2H5的转化率α随时间变化的数据如下表所示:
| t/s | 0 | 120 | 180 | 240 | 330 | 530 | 600 | 700 | 800 |
| α/% | 0 | 33 | 42 | 49 | 59 | 73 | 74 | 75 | 75 |
②为提高O2NC6H4COOC2H5的转化率,可以采取的措施有增加OH-的浓度、移去产物. (写1条即可)
(3)2015年8月12日天津港爆炸中有一定量的氰化物泄露,可用如图2所示装置除去含CN-、Cl-废水中的CN-,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,该反应的离子方程式为2CN-+5ClO-+H2O═N2↑+2CO2↑+5Cl-+2OH-,,其中两个电极的材料分别为石墨和铁,则石墨作阳极,其电极反应式为Cl-+2OH--2e-═ClO-+H2O.
12.某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨).下列叙述正确的是( )
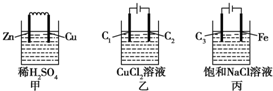

| A. | 甲、丙中是化学能转变为电能,乙中是电能转变为化学能 | |
| B. | C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 | |
| C. | C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同 | |
| D. | 甲、乙、丙中溶液的pH都逐渐升高 |
16.下列说法不正确的是( )
| A. | 用铜作电极电解NaCl溶液,可以实现反应:Cu+2H2O$\frac{\underline{\;电解\;}}{\;}$Cu(OH)2↓+H2↑ | |
| B. | 用铜、铝作电极与电解质溶液构成原电池时,铜一定是正极 | |
| C. | N2O4和NO2混合气体69g,完全与水反应转移电子数约为6.02×1023 | |
| D. | HCl和HS-均是含有一个极性键的18电子粒子 |
17.下列有关物质的制备或保存方法正确的是( )
| A. | 实验室从海带提取单质碘的方法是:取样→灼烧→溶解→过滤→萃取 | |
| B. | 氢氧化钠溶液保存在玻璃塞的试剂瓶中 | |
| C. | 向氯化铝溶液滴入过量的氨水制备氢氧化铝 | |
| D. | 溴化银保存在无色玻璃瓶中 |
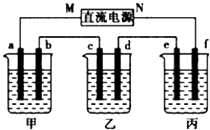 如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题:
如图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g500%的NaOH溶液、足量的CuSO4溶液和l00g10.00%的K2SO4溶液,电极均为石墨电极.接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加.据此回答问题: