题目内容
4.锰锌铁氧体是应用广泛的高性能磁性材料.现以a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%)制备锰锌铁氧体,主要流程如图: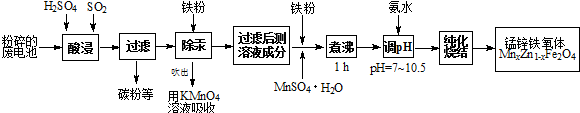
(1)酸浸废电池时,被溶解生成Zn2+的物质有Zn、Zn(OH)2,SO2的作用是D(填字母编号).
A.漂白剂 B.沉淀剂 C.氧化剂 D.还原剂
(2)除汞是以氮气为载体吹入滤液带出汞蒸汽,经KMnO4溶液吸收而实现的.如图是KMnO4溶液处于不同pH时对应的单位时间Hg去除率变化图,图中物质为Hg与MnO${\;}_{4}^{-}$在该pH范围反应的主要产物.
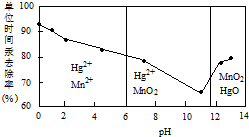
①pH<6时反应的离子方程式为5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O.
②汞的去除速率随pH变化的规律是随pH增大,汞的去除速率先减小后增大.
(3)锌锰干电池中MnO2可以用碳酸锰在空气中煅烧制得.
已知25℃,101 kPa时:2MnO(s)+O2(g)═2MnO2(s)△H=-272.0kJ/mol
MnCO3(s)═MnO(s)+CO2(g)△H=+116.6kJ/mol
碳酸锰在空气中煅烧反应生成MnO2的热化学方程式是2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-38.8 kJ/mol.
(4)x=0.2的锰锌铁氧体具有较高的饱和磁场强度,该锰锌铁氧体的组成用氧化物形式(最简整数比)表示为MnO•4ZnO•5Fe2O3.若制得这种锰锌铁氧体的质量为100kg,在制取过程中不考虑损耗,需补充硫酸锰晶体(MnSO4•H2O)169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$) kg.(只列出计算式)
分析 以含锰废旧碱性锌锰电池为原料制备锰锌铁氧体,二氧化硫能与二氧化锰反应生成硫酸锰,过滤除去不溶性杂质碳粉等,滤液中加入铁粉,铁粉具有还原性,能把汞离子还原为汞单质,除去汞,吹出的汞用高锰酸钾溶液吸收,除汞后的溶液加入铁粉、硫酸锰煮沸,纯化烧结得到锰锌铁氧体.
(1)锌锰电池酸浸废电池时,被溶解生成Zn2+的物质有Zn、Zn(OH)2,SO2的作用是还原剂;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+;
②由图可知,随pH值的升高汞的去除率先降低后增加;
(3)依据热化学方程式和盖斯定律计算得到所需热化学方程式;
(4)Mn为+2价、Zn为+2价,利用化合价代数和为0,计算Fe元素化合价,再结合Mg、Zn、Fe原子数目之比改写为氧化物形式;结合锰原子守恒可知,补充硫酸锰晶体锰的物质的量等于锰锌铁氧体晶体中锰的物质的量与原废旧碱性锌锰电池中锰元素的物质的量之和,进而计算需补充硫酸锰晶体质量.
解答 解:(1)碱性锌锰干电池工作原理为:Zn+2MnO2+2H2O=Zn(OH)2+2MnOOH,酸浸废电池时,锌被溶解生成Zn2+,Zn(OH)2被溶解生成Zn2+,二氧化硫能与二氧化锰反应生成硫酸锰,SO2的作用是还原剂,
故答案为:Zn、Zn(OH)2;D;
(2)①由图可知,pH<6时Hg与酸性高锰酸钾反应生成Hg2+、Mn2+,反应离子方程式为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O,
故答案为:5Hg+2MnO4-+16H+=5Hg2++2Mn2++8H2O;
②由图象可知,汞的吸收率随着PH的增大先减小后增大,
故答案为:随pH增大,汞的去除速率先减小后增大;
(3)2MnO(s)+O2(g)═2MnO2(s)△H=-272.0kJ/mol①
MnCO3(s)═MnO(s)+CO2(g)△H=+116.6kJ/mol②
将①+②×2可得:2MnCO3(S)+O2(g)═2MnO2(S)+2CO2(g)△H=[-272.0+2×(+116.6)]kJ/mol=-38.8 kJ/mol;
故答案为:2MnCO3(s)+O2(g)═2MnO2(s)+2CO2(g)△H=-38.8 kJ/mol;
(4)Mn为+2价、Zn为+2价,当x=0.2时,利用化合价代数和为0,可知Fe元素化合价为+3,改写为氧化物形式为:MnO•4ZnO•5Fe2O3,若制得这种锰锌铁氧体的质量为100kg,则锰的物质的量为$\frac{100×0.2}{239}$mol,a kg废旧碱性锌锰电池为原料(含锰元素的物质:MnO2占b%,MnOOH占c%),所含的锰的物质的量为$\frac{a×b%}{87}+\frac{a×c%}{88}$mol,所以需补充硫酸锰晶体质量169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$),
故答案为:MnO•4ZnO•5Fe2O3;169×($\frac{20}{239}$-$\frac{ab%}{87}$-$\frac{ac%}{88}$).
点评 本题考查锰锌铁氧体制备工艺,侧重考查物质的分离提纯、对操作的分析评价、读图获取信息能力等,侧重考查学生对知识的迁移运用,题目难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 单质的沸点:Z>X>Y | |
| B. | 单质的氧化性:W<Z<Y<X | |
| C. | 气态氢化物的稳定性:W>X>Y>Z | |
| D. | W单质可以将X从其盐溶液中置换出来 |
| A. | CH3COOH在水中电离:CH3COOH═H++CH3COO- | |
| B. | 乙醇氧化成乙醛的化学方程式:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O | |
| C. | 乙酸与乙醇发生酯化反应:CH3COOH+CH3CH2OH$→_{△}^{催化剂}$CH3COOCH2CH3 | |
| D. | CaCO3高温分解的热化学方程式:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,△H=+178.5 kJ•mol-1 |
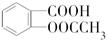 )是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下:
)是世界上应用最广泛的解热、镇痛和抗炎药.乙酰水杨酸受热易分解,分解温度为128℃~135℃.某学习小组在实验室以水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O]为主要原料合成阿司匹林,反应原理如下: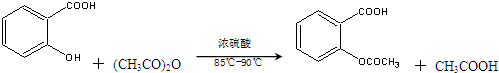
制备基本操作流程如下:
醋酸酐+水杨酸$\stackrel{浓硫酸}{→}$$\stackrel{摇匀}{→}$$\stackrel{85-90℃℃加热}{→}$$\stackrel{冷却}{→}$$→_{洗涤}^{减压过滤}$粗产品
主要试剂和产品的物理常数如下表所示:
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水 |
| 水杨酸 | 138 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 易水解 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)制备阿司匹林时,要使用干燥的仪器的原因是乙酸酐与水反应.
(2)合成阿司匹林时,最合适的加热方法是水浴加热.
(3)提纯粗产品流程如下,加热回流装置如图:
粗产品$→_{沸石}^{乙酸乙酯}$$→_{回流}^{加热}$$\stackrel{趁热过滤}{→}$$→_{减压过滤}^{冷却}$$→_{干燥}^{洗涤}$乙酰水杨酸
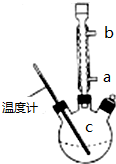
①使用温度计的目的是控制加热的温度,防止乙酰水杨酸受热易分解.
②冷凝水的流进方向是a(填“a”或“b”);
③趁热过滤的原因是防止乙酰水杨酸结晶析出.
④下列说法正确的是abc(填选项字母).
a.此种提纯方法中乙酸乙酯的作用是做溶剂
b.此种提纯粗产品的方法叫重结晶
c.根据以上提纯过程可以得出阿司匹林在乙酸乙酯中的溶解度低温时小
d.可以用紫色石蕊溶液判断产品中是否含有未反应完的水杨酸
(4)在实验中原料用量:2.0g水杨酸、5.0mL醋酸酐(ρ=1.08g/cm3),最终称得产品质量为2.2g,则所得乙酰水杨酸的产率为84.3%(用百分数表示,小数点后一位).
(1)硫酸铜溶液可以加快氢气生成速率的原因是CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(2)要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度(答两种);
(3)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是阳极 | |
| C. | 铜电极表面的电极反应式为CO2+8e-+8H+═CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |

