题目内容
13. 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4.下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是阳极 | |
| C. | 铜电极表面的电极反应式为CO2+8e-+8H+═CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
分析 该装置中,根据电子流向知,GaN是负极、Cu是正极,负极反应式为2H2O-4e-=4H++O2↑,正极反应式为CO2+8e-+8H+=CH4+2H2O,电解质溶液中阳离子向正极移动,据此分析解答.
解答 解:A.根据图知,该装置中有太阳能转化为化学能、化学能转化为电能,故A错误;
B.根据电子流向知,GaN是负极,故B错误;
C.Cu是正极,正极反应式为CO2+8e-+8H+=CH4+2H2O,故C正确;
D.由于负极Cl-的放电强于OH-,导致生成氯气,所以不能用盐酸作电解液,故D错误;
故选C.
点评 本题考查化学电源新型电池,明确原电池原理、电极反应等即可解答,难点是电极反应式的书写,题目难度中等,侧重于考查学生对原电池原理的应用能力.

练习册系列答案
相关题目
1.已知:C(s)+2NO(g)?N2(g)+CO2(g). T℃时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
(1)0~10min以V(NO)表示的平均反应速率为0.042mol/(L•min).
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
8.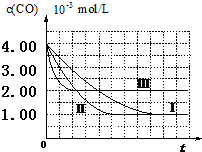 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如图:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
5.下列有关问题和评价均正确的是( )
| 选项 | 问题 | 评价 |
| A | 用稀硝酸清洗做过银镜反应的试管 Ag+4H++NO3-=Ag++NO↑+2H2O | 错误,物质拆分错误 |
| B | 离子组 Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为发生反应: HCO3-+OH-=H2O+CO2↑ |
| C | 反应: Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq) | 该反应的平衡常数表达式:K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ |
| D | 在硫酸氢钠溶于水的过程中 | 只有离子键被破坏没有共价键被破坏 |
| A. | A | B. | B | C. | C | D. | D |
2.Fe(NO3)2加热分解反应为Fe(NO3)2--Fe2O3+NO2↑+O2↑(未配平),Hg(NO3)2加热分解反应为Hg(NO3)2--Hg+NO2↑+O2↑(未配平).将Fe(NO3)2与Hg(NO3)2的混合物加热后,放出的气体通过排水法收集时得不到气体,由此可知混合物中Fe(NO3)2 与Hg(NO3)2物质的量之比为( )
| A. | 1:1 | B. | 2:1 | C. | 1:2 | D. | 无法计算 |
3.下列分子晶体中,关于熔、沸点高低的叙述正确的是( )
| A. | H2>N2>O2 | |
| B. | NH3>AsH3>PH3 | |
| C. | Cl2>Br2>I2 | |
| D. | C(CH3)4>(CH3)2CHCH2CH3>CH3CH2CH2CH2CH3 |
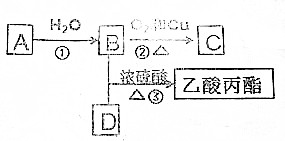
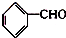
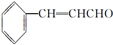 )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要按如下路线合成: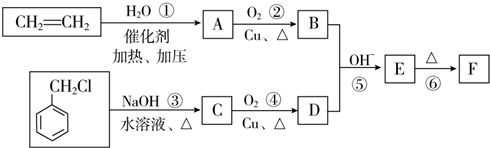
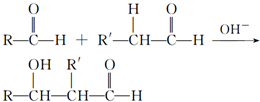
 ,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.
,检验其中官能团的试剂为银氨溶液或新制的Cu(OH)2悬浊液.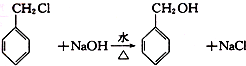 .
.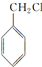 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是BCDA(请用序号填写).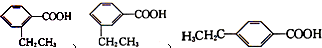 三种任写一种即可.
三种任写一种即可.