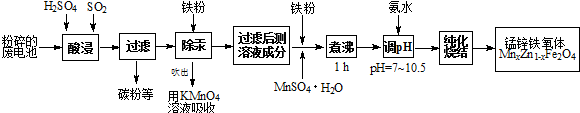
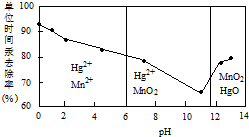
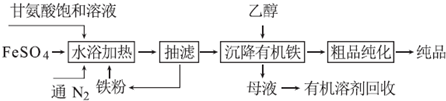
题目内容
16.下列说法中正确的是( )| A. | 难溶电解质的Ksp越小,溶解度就一定越小 | |
| B. | 向含AgCl沉淀的悬浊液中加入NaCl饱和溶液,AgCl的溶解度变小,溶度积常数变小 | |
| C. | 用饱和Na2CO3溶液可以将BaSO4转化为BaCO3,说明Ksp(BaCO3)小于Ksp(BaSO4) | |
| D. | 一般认为沉淀离子浓度小于1.0×10-5 mol/L时,离子就已沉淀完全 |
分析 A.Ksp越小,电解质的溶解度不一定越小,溶度积常数与温度有关系,与溶液类型以及浓度无关;
B.溶度积常数与温度有关系,与溶液类型以及浓度无关;
C.若满足Qc>Ksp,可生成沉淀;
D.沉淀不可能完全沉淀,当离子浓度小于1.0×10-5mol/L时,可认为沉淀完全.
解答 解:A.Ksp越小,电解质的溶解度不一定越小,溶解度还取决于溶液的类型和浓度关系,以及物质的摩尔质量等因素,例如AgCl在水中和盐酸中的溶解度不同,但溶度积相同,故A错误;
B.溶度积常数与温度有关系,与溶液类型以及浓度无关,故B错误;
C.BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀,是因为碳酸根离子浓度大,和钡离子浓度乘积等于碳酸钡的Ksp,实际Ksp(BaSO4)小于Ksp(BaCO3),故C错误;
D.沉淀不可能沉淀完全,当离子浓度小于1.0×10-5mol/L时,可认为沉淀完全,故D正确;
故选D.
点评 本题考查了沉淀溶解平衡及其影响,题目难度不大,注意绝对不溶的物质是没有的,满足Qc>Ksp,可生成沉淀,明确溶解平衡及其影响为解答关键,试题培养了学生的灵活应用能力.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
17.短周期主族元素X、Y、Z、W的原子序数依次增大,它们原子的最外层电子数之和为19.Y原子的电子层数与最外层电子数的比等于$\frac{1}{3}$,Z原子最外层电子数与内层电子数的比为$\frac{1}{10}$.下列说法正确的是( )
| A. | 非金属性:Y<X<W | |
| B. | 简单气态氢化物的热稳定性:Y<X | |
| C. | 化合物ZW、XY中化学键类型相同 | |
| D. | X、W的最高价氧化物的水化物均为强酸 |
7.“碘钟”实验中,3I-+S2O${\;}_{8}^{2-}$═I${\;}_{3}^{-}$+2SO${\;}_{4}^{2-}$的反应速率可以用I${\;}_{3}^{-}$与加入的淀粉溶液显蓝色的时间t来度量,t越小,反应速率越大.某探究性学习小组在20℃进行实验,得到的数据如下表:
回答下列问题:
(1)该实验的目的是:研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比.
| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol/L | 0.040 | 0.080 | 0.080 | 0.160 | 0.120 |
| c(S2O${\;}_{8}^{2-}$)/mol/L | 0.040 | 0.040 | 0.080 | 0.020 | 0.040 |
| t/s | 88.0 | 44.0 | 22.0 | 44.0 | t1 |
(1)该实验的目的是:研究反应物I-与S2O82-的浓度对反应速率的影响.
(2)根据①、②、⑤三个实验的数据,推测显色时间t1=29.3s.
(3)温度对该反应的反应速率的影响符合一般规律,若在40℃下进行编号③对应浓度的实验,显色时间t2的范围为A(填字母).
A.<22.0s B.22.0~44.0s C.>44.0s D.数据不足,无法判断
(4)通过分析比较上表数据,得到的结论反应速率与反应物起始浓度乘积成正比(或显色时间与反应物起始浓度乘积成反比.
1.已知:C(s)+2NO(g)?N2(g)+CO2(g). T℃时.某研究小组向一恒容真空容器中充入NO和足量的碳单质,恒温条件下测得不同时间各物质的浓度如表.
(1)0~10min以V(NO)表示的平均反应速率为0.042mol/(L•min).
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
| 浓度/mol•L-1 时间/min | NO | N2 | CO2 |
| 0 | 1.00 | 0 | 0 |
| 10 | 0.58 | 0.21 | 0.21 |
| 20 | 0.40 | 0.30 | 0.30 |
| 30 | 0.40 | 0.30 | 0.30 |
| 35 | 0.32 | 0.34 | 0.15 |
(2)根据表中数据,计算平衡时的NO转化率为60%.
(3)根据表中数据,计算T℃时该反应的平衡常数为0.56.
(4)30~35min改变的实验条件是分离出CO2.
8.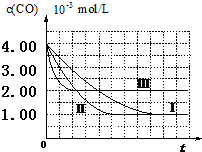 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
【图象分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如图:
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
 目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
(1)完成以下实验设计表(表中不要留空格).
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积m2/g |
| Ⅰ | 为以下实验作参照 | 280 | 6.50×10-3 | 4.00×10-3 | 80 |
| Ⅱ | 6.50×10-3 | 120 | |||
| Ⅲ | 探究温度对尾气转化速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 |
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为3.50×10-3mol/L;
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率增大(填“增大”、“减小”、“无影响”).
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥.而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2?2NH3
(1)在N2+3H2?2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol•L-1.用N2表示其反应速率为0.15mol•L-1•s-1,则所经过的时间为B;
A.2s B.3s C.4s D.6s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是D;
A.v(H2)=0.1mol•L-1•min-1 B.v(N2)=0.1mol•L-1•min-1
C.v(NH3)=0.15mol•L-1•min-1 D.v(N2)=0.002mol•L-1•s-1.
5.下列有关问题和评价均正确的是( )
| 选项 | 问题 | 评价 |
| A | 用稀硝酸清洗做过银镜反应的试管 Ag+4H++NO3-=Ag++NO↑+2H2O | 错误,物质拆分错误 |
| B | 离子组 Na+、K+、HCO3-、OH- | 不能大量共存于同一溶液中,因为发生反应: HCO3-+OH-=H2O+CO2↑ |
| C | 反应: Cu2+(aq)+MnS(s)?CuS(s)+Mn2+(aq) | 该反应的平衡常数表达式:K=$\frac{{K}_{sp}(MnS)}{{K}_{sp}(CuS)}$ |
| D | 在硫酸氢钠溶于水的过程中 | 只有离子键被破坏没有共价键被破坏 |
| A. | A | B. | B | C. | C | D. | D |
6.以下说法中正确的是( )
| A. | △H<0的反应均是自发反应 | |
| B. | 自发进行的反应一定能迅速进行 | |
| C. | 高锰酸钾加热分解是一个熵减小的过程 | |
| D. | 冰在室温下自动熔化成水,是熵增的重要结果 |