题目内容
14.25℃时,电离常数Ka(HF)=3.6×10-4mol/L,溶度积Ksp(CaF2)=1.46×10-10,Ksp(AgCl)=4×10-10,Ksp(AgI)=1.0×10-16.下列说法正确的是( )| A. | AgCl不能转化为AgI | |
| B. | 25℃时,0.1mol/L HF溶液pH=l | |
| C. | 向1L0.1 mol/LHF溶液中加入1L 0.1 mol/LCaCl2溶液,没有沉淀产生 | |
| D. | 25℃时,使AgCl转化为AgI,则加入KI溶液的浓度不低于5×10-12 mol/L |
分析 A.溶解度小的转化为溶解度更小的容易实现;
B.HF为弱酸,不能完全电离;
C.据Ksp(CaF2)与Qc(CaF2)判断;
D.根据Ksp(AgCl)求出c(Ag+),再利用Ksp(AgI)求出碘离子的浓度.
解答 解:A.AgCl难溶,但是AgI溶解度更小,所以AgCl能转化为,故A错误;
B.AgIHF为弱酸,不能完全电离,所以常温下O.1 mol•L-1HF溶液pH>l,故B错误;
C.向1L0.1 mol•L-1HF溶液中加入1L 0.1 mol•L-1CaCl2溶液,Qc(CaF2)=0.05×0.052=1.25×10-4>Ksp(CaF2)=1.46×10-10,有沉淀生成,故C错误;
D.已知Ksp(AgCl)=1.8×10-10,则c(Ag+)=$\sqrt{Ksp(AgCl)}$=$\sqrt{4×1{0}^{-10}}$=2.0×10-5mol/L,c(I-)=$\frac{Ksp(AgI)}{c(A{g}^{+})}$=$\frac{1.0×1{0}^{-16}}{2.0×1{0}^{-5}}$=5×10-12mol/L,所以加入KI溶液的浓度不低于5×10-12 mol/L,故D正确;
故选D.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积常数的计算及应用,侧重于考查学生的分析能力和计算能力.

练习册系列答案
相关题目
19.蜂蜜是家庭生活中常见的一种营养品.下表是某品牌蜂蜜外包装上标识的“营养成分表”
说明:表中所列“碳水化合物”主要指一些糖类物质.
(1)在六大基本营养素中,除水之外,上表中没有列出的是维生素;
(2)表中的“钠”是指钠元素,
(3)服用蜂蜜可有效补充人体所需能量,其中提供能量的主要是碳水化合物(或糖类).
(4)麦芽糖(C12H22O11)是蜂蜜中的一种碳水化合物,它在一定条件下可实现如下转化:C12H22O11+X═2C6H12O6,X的化学式为H2O,反应类型是化合反应.
| 项 目 | 每100克(g) | 营养素参考值% |
| 能 量 | 1500kJ | 18% |
| 蛋 白 质 | 0g | 0% |
| 脂 肪 | 2.0g | 3% |
| 碳水化合物 | 72g | 24% |
| 钠 | 30mg | 2% |
(1)在六大基本营养素中,除水之外,上表中没有列出的是维生素;
(2)表中的“钠”是指钠元素,
(3)服用蜂蜜可有效补充人体所需能量,其中提供能量的主要是碳水化合物(或糖类).
(4)麦芽糖(C12H22O11)是蜂蜜中的一种碳水化合物,它在一定条件下可实现如下转化:C12H22O11+X═2C6H12O6,X的化学式为H2O,反应类型是化合反应.
2.相同温度下,将足量的AgCl分别放入下列溶液中:①40mL 0.02mol/L BaCl2溶液②40mL 0.03mol/L 盐酸 ③10mL 蒸馏水 ④50mL0.05mol/L AgNO3溶液,则AgCl的溶解度大小顺序为( )
| A. | ①=②=③=④ | B. | ③>②>①>④ | C. | ④>②>①>③ | D. | ③>①>②>④ |
9.当固体AgCl放在较浓的KI溶液中振荡时,则部分AgCl转化为AgI,原因是( )
| A. | AgI比AgCl稳定 | B. | 碘氧化性比氯弱 | ||
| C. | I-的还原性比Cl-强 | D. | 溶解度AgI<AgCl |
6.X、Y、Z、W、R是5种短周期元素,其原子序数依次增大.X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等.下列说法正确的是( )
| A. | 元素Y、Z、W具有相同电子层结构的离子,其半径依次增大 | |
| B. | 元素Y能与元素Z形成化合物Z2Y2,该化合物内部有两种化学键 | |
| C. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR,沸点XmY<XmR | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
3.下列陈述Ⅰ、Ⅱ均正确且具有因果关系的是( )
| 选项 | 陈述Ⅰ | 陈述Ⅱ |
| A | SO2有漂白性 | SO2可使溴水褪色 |
| B | NH3具有碱性 | NH3极易溶于水 |
| C | 浓硫酸有吸水性 | 用浓硫酸干燥SO2 |
| D | HNO3具有酸性 | 可用铁和稀HNO3制取氢气 |
| A. | A | B. | B | C. | C | D. | D |


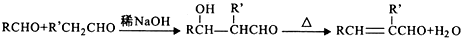
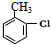 ,H→I两步反应的反应类型加成反应、消去反应.
,H→I两步反应的反应类型加成反应、消去反应.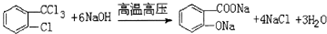 ,E→F
,E→F

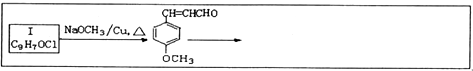
 探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质:
探究上述四种酸的氧化性相对强弱及其与铜反应的还原产物的性质: