题目内容
5.下表为元素周期表的一部分,表中列出了10种元素在周期表中的位置,按要求完成下列各小题.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑥ | ⑦ | ⑨ | |||||
| 3 | ① | ③ | ⑤ | ⑩ | ||||
| 4 | ② | ④ | ⑧ |

(2)元素⑧的名称为溴,其最高价氧化物的水化物的化学式为HBrO4
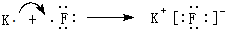
(3)用电子式表示元素②与元素⑨形成化合物的过程
(4)非金属性最强的元素是F(填元素符号);除0族外原子半径最大的元素是K (填元素符号);元素①的一种氧化物中既含有离子键又有共价键,它的电子式是

(5)①、③、⑨三种元素形成的简单离子半径由大到小的顺序为F->Na+>Mg2+(用离子符号表示)
(6)元素③和⑦形成的化合物与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,写出该反应的化学方程式Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
分析 由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Br、⑨为F、⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,根据核外电子排布画出原子结构示意图;
(2)元素⑧是溴元素,最高价氧化物的水化物为高溴酸;
(3)元素②与元素⑨形成化合物KF,由钾离子与氟离子构成;
(4)同周期自左而右非金属性增强、原子半径减小,同主族自上而下非金属性减弱、原子半径增大;
元素①的一种氧化物中既含有离子键又有共价键,该氧化物为过氧化钠,由钠离子与过氧根离子构成;
(5)电子层结构相同的离子,核电荷数越大离子半径越小;
(6)元素③和⑦形成的化合物(Mg3N2)与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,即反应生成氢氧化镁与氨气.
解答 解:由元素在周期表中的位置可知,①为Na、②为K、③为Mg、④为Ca、⑤为Al、⑥为C、⑦为N、⑧为Br、⑨为F、⑩为Ar.
(1)稀有气体Ar的化学性质最不活泼,原子核外电子数为18,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)元素⑧是溴元素,最高价氧化物的水化物为高溴酸,化学式为:HBrO4,故答案为:溴;HBrO4;
(3)元素②与元素⑨形成化合物KF,由钾离子与氟离子构成,用电子式表示形成过程为: ,
,
故答案为: ;
;
(4)同周期自左而右非金属性增强、原子半径减小,同主族自上而下非金属性减弱、原子半径增大,故上述元素中非金属性最强的为F,原子半径最大为K;
元素①的一种氧化物中既含有离子键又有共价键,该氧化物为过氧化钠,由钠离子与过氧根离子构成,电子式为: ,
,
故答案为:F;K; ;
;
(5)电子层结构相同的离子,核电荷数越大离子半径越小,故离子半径:F->Na+>Mg2+,故答案为:F->Na+>Mg2+;
(6)元素③和⑦形成的化合物(Mg3N2)与水能剧烈反应,其反应的实质是阴阳离子分别与水电离产生的H+和OH-离子重新组合,生成新的物质,即反应生成氢氧化镁与氨气,反应方程式为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑,
故答案为:Mg3N2+6H2O=3Mg(OH)2+2NH3↑.
点评 本题考查元素周期表与元素周期律的综合应用,侧重对元素周期律的考查,熟练掌握周期表的结构,掌握用电子式表示化学键或物质的形成.

 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案| A. | 3s2 3p3 | B. | 4s2 | C. | 4s2 4p1 | D. | 3s2 3p5 |
| A. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| B. | 乙烯和聚乙烯都是不饱和烃,都能使酸性高锰酸钾溶液褪色 | |
| C. | 1mol苯分子中含有碳碳双键数为3NA | |
| D. | 要检验溴乙烷中的溴元素,可加入Na0H溶液共热一会儿,冷却后加入稀硝酸呈酸性,再滴入AgNO3溶液,观察有无浅黄色沉淀生成 |
| A. | 氧化反应 | B. | 加成反应 | C. | 消去反应 | D. | 取代反应 |
 四氯化碳
四氯化碳 CO2
CO2 HClO
HClO 氯化铵
氯化铵 Na2O2
Na2O2





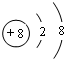 ,D在元素周期表中的位置第二周期VIA族.
,D在元素周期表中的位置第二周期VIA族.  .
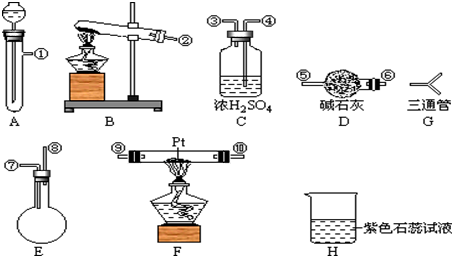
.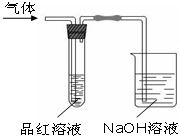 某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.
某化学兴趣小组,拟探究和比较SO2和Cl2的漂白性,设计如下图所示的实验装置二套.请你参与探究并回答下列问题.