题目内容
6.在100mL a mol/L的AlCl3溶液中加入100mL b mol/L的NaOH溶液,试讨论a、b关系不同时,溶液中所生成的沉淀质量,填写表格:| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
分析 NaOH加入到AlCl3,所以先发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,直至AlCl3全部消耗完,然后再滴加NaOH有:Al(OH)3+NaOH=NaAlO2+2H2O
叠加上面的反应有:4NaOH+AlCl3=3NaCl+NaAlO2+2H2O,根据发生的反应结合碱的用量来计算.
解答 解:NaOH加入到AlCl3,所以先发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,直至AlCl3全部消耗完,然后再滴加NaOH有:Al(OH)3+NaOH=NaAlO2+2H2O
叠加上面的反应有:4NaOH+AlCl3=3NaCl+NaAlO2+2H2O,
(1)当b≤3a时,生成氢氧化铝的物质的量为:100×b×10-3×$\frac{1}{3}$=$\frac{b}{30}$mol,质量是$\frac{b}{30}mol$×78g/mol=2.6bg;
(2)当a.b满足b≥4a时,无沉淀生成;
(3)当a.b满足当3a<b<4a时,沉淀量先最大,然后是逐渐溶解,此时得到沉淀的量是(0.4a-0.1b)mol,质量是(0.4a-0.1b)mol×78g/mol=(31.2a-7.8b)g;
故答案为:
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
点评 本题考查铝离子与碱的反应,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.

练习册系列答案
相关题目
16.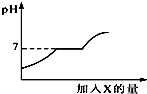 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
9.下列有关能量转化的认识,不正确的是( )
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |