题目内容
8.氨基甲酸铵(H2N-COONH4)是一种用途广泛的化工原料.某研究性学习小组设计如下所示装置,用于合成少量氨基甲酸铵.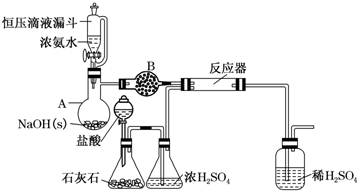
有关氨基甲酸铵的资料如下:
①常温下,在干燥的空气中稳定,遇水或潮湿空气则生成碳酸铵或碳酸氢铵
②熔点58℃,59℃时则可分解成NH3和CO2气体
③在密封管内加热至120~140℃时失水生成尿素[CO(NH2)2]
④在酸性溶液中迅速分解
⑤合成氨基甲酸铵的反应原理为2NH3(g)+CO2(g)?H2N-COONH4(s)
请回答下列问题:
(1)仪器A的名称是干燥管;B中盛放的药品是碱石灰
(2)写出石灰石与盐酸反应的离子方程式:CaCO3+2H+=Ca2++H2O+CO2↑
(3)写出氨基甲酸铵在密封管内加热至120~140℃生成尿素的化学反应方程式:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O
(4)合成氨基甲酸铵的反应在一定条件下能自发进行,该反应的反应热△H<0(填“>”“=”或“<”).
(5)有同学建议该CO2发生装置直接改用“干冰”,你认为他的改进有何优点:无需干燥装置简单,低温环境提高产率
(6)该实验装置中明显导致实验失败的隐患有反应器连接导管过细易造成堵塞;水蒸气可进入反应器使产品不纯;CO2发生器中挥发出的HCl未经处理进入反应器,会导致实验失败.
分析 浓氨水在氢氧化钠作用下生成氨气,氨气在B中可用碱石灰干燥,浓盐酸和石灰石反应生成二氧化碳,用浓硫酸干燥,在反应器中,一定条件下反应生成H2N-COONH4,稀硫酸用于吸收氨气,防止污染环境.
(1)依据图形和作用分析仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰;
(2)石灰石与盐酸反应生成二氧化碳和水;
(3)对比氨基甲酸铵的结构简式与尿素的结构简式可写出反应方程式;
(4)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0;
(5)使用干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成;不用对干冰进行干燥处理;
(6)导管过细有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等.
解答 解:(1)仪器B为干燥管(球形干燥管),由连接的A制备氨气可知,干燥管B中盛装的是碱石灰,用来干燥氨气,
故答案为:干燥管;碱石灰;
(2)石灰石与盐酸反应生成二氧化碳和水,反应的离子方程式为CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:CaCO3+2H+=Ca2++H2O+CO2↑;
(3)对比氨基甲酸铵的结构简式与尿素的结构简式,依据原子守恒得到氨基甲酸铵在密封管内加热至120℃-140℃生成尿素的反应方程式为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O,
故答案为:NH2COONH4$\frac{\underline{\;\;△\;\;}}{\;}$CO(NH2)2+H2O;
(4)反应在一定条件下能自发进行,则△G=△H-T△S<0,由于△S<0,所以△H必须小于0,△H<0,
故答案为:<;
(5)干冰代替CO2发生装置的优点有很多,如省去了复杂仪器的连接,使得装置较为简单,易于操作,无需干燥,装置简单;由(3)可知合成氨基甲酸铵的反应为放热反应,故干冰创造的低温环境有利于氨基甲酸铵的生成,不用对干冰进行干燥处理,低温环境提高产率,
故答案为:无需干燥装置简单,低温环境提高产率;
(6)从实验装置可以看出导管过细,有可能导致堵塞现象发生;用盐酸制备的二氧化碳气体中混有的HCl消耗氨气;稀硫酸、水蒸气进入反应器使产品不纯等,
故答案为:反应器连接导管过细易造成堵塞;水蒸气可进入反应器使产品不纯;CO2发生器中挥发出的HCl未经处理进入反应器,会导致实验失败.
点评 本题考查物质的制备,为高考常见题型,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及实验的原理和操作方法,难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |

②金属阳离子生成氢氧化物沉淀的pH如下表:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
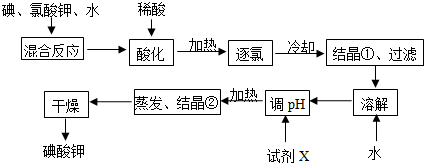
(1)写出滤渣1的一种工业用途:建筑材料.实验室模拟该流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填选项字母).
A.氯水 B.高锰酸钾
C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母).
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,写出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.
(6)KMnO4是一种常用的滴定试剂,某同学用酸性高锰酸钾溶液测定滤液1中Fe2+的含量.滴定过程中,每次均量取25.00mL的滤液1置于锥形瓶中,滴定三次平均消耗掉0.1000mol/L的KMnO4溶液20.00mL,则滤液1中Fe2+的浓度为22.4g/L(保留三位有效数字).
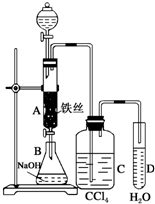 某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图所示的装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中. .
.