题目内容
17.标况下,CO与CO2的混合气体共33.6L,质量为60g.则两种气体的物质的量之和为1.5mol,其中CO的体积分数是25%.分析 根据n=$\frac{V}{{V}_{m}}$计算物质的量,根据总质量和总物质的量列式计算可得CO和CO2的质量,进而计算CO的体积分数.
解答 解:标准状况下Vm=22.4L/mol,两种气体总的物质的量为:n=$\frac{33.6L}{22.4L/mol}$=1.5mol,
设CO的物质的量为x、CO2的物质的量为y,
则:x+y=1.5,28x+44y=60,
解得:x=0.375mol,y=1.125mol,
相同条件下气体体积分数等于其物质的量分数,则混合气体中CO的体积分数为:$\frac{0.375mol}{1.5mol}$×100%=25%,
故答案为:1.5;25%.
点评 本题考查混合物的计算,为高频考点,题目难度不大,侧重于学生的分析能力和计算能力的考查,注意相关物理量计算公式的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
7.硒鼓回收料含硒约97%,其余为约3%的碲和微量的氯.从该回收料中回收硒的工艺流程如图所示(已知煅烧过程中,回收料中的硒、碲被氧化成SeO2和TeO2):
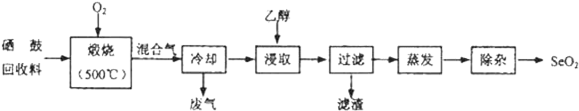
部分物质的物理性质如表:
回答下列问题:
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第四周期ⅥA族;H2Se的热稳定性比H2S的热稳定性弱(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是TeO2.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是升华.
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式H2SeO3+4HI=Se↓+2I2+3H2O.
(4)已知H2SeO3的电离常数K1=3.5×10-3、K2=5.0×10-8,回答下列问题:
①Na2SeO3溶液呈碱性,原因是(用离子方程式表示)SeO32-+H2O?HSeO3-+OH-;
②在Na2SeO3溶液中,下列关系式正确的是C:
A.c(Na+)+c(H+)═c(SeO32-)+c(HSeO3-)+c(OH-)
B.2c(Na+)═c(SeO32-)+c(HSeO3-)+c(H2SeO3)
C.c(Na+)═2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3)
D.c(OH-)═c(H+)+c(HSeO3-)+c(H2SeO3)

部分物质的物理性质如表:
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
(1)Se与S是同族元素,比S多1个电子层,Se在元素周期表的位置为第四周期ⅥA族;H2Se的热稳定性比H2S的热稳定性弱(填“强”或“弱”).
(2)乙醇浸取后过滤所得滤渣的主要成分是TeO2.蒸发除去溶剂后,所得固体中仍含有少量TeO2杂质,除杂时适宜采用的方法是升华.
(3)SeO2易溶于水得到H2SeO3溶液,向溶液中通入HI气体后,再加入淀粉溶液,溶液变蓝色,同时生成Se沉淀,写出反应的化学方程式H2SeO3+4HI=Se↓+2I2+3H2O.
(4)已知H2SeO3的电离常数K1=3.5×10-3、K2=5.0×10-8,回答下列问题:
①Na2SeO3溶液呈碱性,原因是(用离子方程式表示)SeO32-+H2O?HSeO3-+OH-;
②在Na2SeO3溶液中,下列关系式正确的是C:
A.c(Na+)+c(H+)═c(SeO32-)+c(HSeO3-)+c(OH-)
B.2c(Na+)═c(SeO32-)+c(HSeO3-)+c(H2SeO3)
C.c(Na+)═2c(SeO32-)+2c(HSeO3-)+2c(H2SeO3)
D.c(OH-)═c(H+)+c(HSeO3-)+c(H2SeO3)
5.设NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
12.在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2+9H2O反应中,氧化剂与还原剂物质的量之比是( )
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
2.室温下,将0.1molNa2CO3固体溶于水配成100mL溶液,改变下列条件,则有关结论不正确的是( )
| 选项 | 改变的条件 | 结论 |
| A | 升温 | CO32-的水解平衡向右移动 |
| B | 加入AlCl3固体 | 产生大量气体 |
| C | 加入100mLH2O | 溶液中c(H+)、c(OH-)均减小 |
| D | 加入少量CH3COONa固体 | 溶液中n(CO32-)增大 |
| A. | A | B. | B | C. | C | D. | D |
6.在100mL a mol/L的AlCl3溶液中加入100mL b mol/L的NaOH溶液,试讨论a、b关系不同时,溶液中所生成的沉淀质量,填写表格:
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
20.工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取KMnO4.其流程示意图如下:

②金属阳离子生成氢氧化物沉淀的pH如下表:
回答下列问题:
(1)写出滤渣1的一种工业用途:建筑材料.实验室模拟该流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填选项字母).
A.氯水 B.高锰酸钾
C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母).
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,写出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.
(6)KMnO4是一种常用的滴定试剂,某同学用酸性高锰酸钾溶液测定滤液1中Fe2+的含量.滴定过程中,每次均量取25.00mL的滤液1置于锥形瓶中,滴定三次平均消耗掉0.1000mol/L的KMnO4溶液20.00mL,则滤液1中Fe2+的浓度为22.4g/L(保留三位有效数字).

②金属阳离子生成氢氧化物沉淀的pH如下表:
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉定时 | 8.3 | 7.6 | 2.7 | 6.7 |
| 完全沉淀时 | 9.8 | 9.6 | 3.7 | 9 |
(1)写出滤渣1的一种工业用途:建筑材料.实验室模拟该流程过程中,洗涤滤渣1的具体操作方法为将沉淀放在过滤器中,水浸没沉淀自然流下,重复2~3次.
(2)试剂a最好选用B(填选项字母).
A.氯水 B.高锰酸钾
C.次氯酸钠 D.浓盐酸
(3)试剂b可选用CD(填选项字母).
A.氨水 B.稀硫酸 C.碳酸锰 D.Mn(OH)2 E.NaOH
(4)试剂c为MnS,写出滤液2中加入MnS后发生反应的离子方程式:MnS+Cu2+=Mn2++CuS
(5)用惰性电极电解硫酸锰和硫酸钾混合溶液的方法可以制取高锰酸钾,写出电解时的阳极反应式:Mn2+-5e-+4H2O=8H++MnO4-.工业上用硫酸溶解碳酸锰,而不用盐酸溶解,其原因是氯离子放电生成有毒气体氯气.
(6)KMnO4是一种常用的滴定试剂,某同学用酸性高锰酸钾溶液测定滤液1中Fe2+的含量.滴定过程中,每次均量取25.00mL的滤液1置于锥形瓶中,滴定三次平均消耗掉0.1000mol/L的KMnO4溶液20.00mL,则滤液1中Fe2+的浓度为22.4g/L(保留三位有效数字).