题目内容
1.7.8g Na2O2与足量水反应时转移电子的个数是多少?分析 根据过氧化钠的质量计算出物质的量,再计算出完全反应转移的电子数.
解答 解:7.8g过氧化钠的物质的量为0.1mol,完全反应生成0.05mol氧气,转移电子的物质的量为0.05mol×2×1=0.1mol,转移的电子数为 0.1NA,
答:7.8g Na2O2与足量水反应时转移电子的个数是0.1NA.
点评 本题考查了转移电子的个数的计算,注意抓住化合价变化计算,本题难度不大.

练习册系列答案
相关题目
12.在5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2+9H2O反应中,氧化剂与还原剂物质的量之比是( )
| A. | 5:8 | B. | 5:4 | C. | 5:3 | D. | 3:5 |
6.在100mL a mol/L的AlCl3溶液中加入100mL b mol/L的NaOH溶液,试讨论a、b关系不同时,溶液中所生成的沉淀质量,填写表格:
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
6. 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
已知:
实验步骤: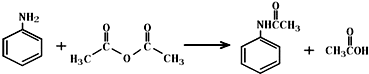
①取5.0mL 苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤(用于分离粒径较细的沉淀与溶剂,利用抽气泵使抽滤瓶中的压强降低,加快过滤速度),洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)苯胺与乙酸反应的方程式为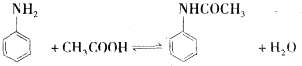 .
.
(2)步骤②洗涤粗产品时,选用的溶剂是B.
A.热水 B.冷水
C.1:3的乙醇溶液 D.滤液
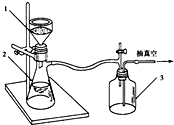
(3)步骤③两次用到过滤,其中过滤Ⅰ选择趁热过滤,是为了除去吸附有色物质的活性炭,为加快过滤速度,可采用右图所示的抽滤装置,这样做的优点是快速达到固液分离的目的,防止过滤太慢温度降低导致其他产物析出,影响产率.
(4)配制热溶液时,加入过量溶剂的作用是AB.
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(5)步骤③中以下哪些操作不能提高产率C.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤B.①④C.④⑤D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,该实验的产率为89%(保留两位有效数字).
 乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.
乙酰苯胺作为一种常用药,具有解热镇痛的效果.实验室制备乙酰苯胺时,可以用苯胺与乙酸酐或与冰醋酸加热来制取,苯胺与乙酸酐的反应速率远大于与冰醋酸反应的速率.已知:
| 名称 | 式量 | 性状 | 密度/g/cm3 | 沸点/℃ | 溶解度 |
| 苯胺 | 93 | 无色油状液体,具有还原性 | 1.02 | 184.4 | 微溶于水,易溶于乙醇、乙醚等 |
| 乙酰苯胺 | 135 | 白色晶体 | 1.22 | 304 | 微溶于冷水,溶于热水,易溶于乙醇、乙醚 |

①取5.0mL 苯胺(密度1.04g/mL),倒入100mL锥形瓶中,加入20mL水,在旋摇下分批加入6.0mL乙酸酐(密度1.08g/mL),搅拌均匀.若有结块现象产生,用玻璃棒将块状物研碎,再充分搅拌;
②反应完全后,及时把反应混合物转移到烧杯中,冷却后,抽滤(用于分离粒径较细的沉淀与溶剂,利用抽气泵使抽滤瓶中的压强降低,加快过滤速度),洗涤,得粗乙酰苯胺固体;
③将粗产品转移至150mL烧杯中,加入适量水配制成80℃的饱和溶液,再加入过量20%的水.稍冷后,加半匙活性炭,搅拌下将溶液煮沸3~5min,过滤Ⅰ,用少量沸水淋洗烧杯和漏斗中的固体,合并滤液,冷却结晶,过滤Ⅱ、洗涤、晾干得乙酰苯胺纯品.
(1)苯胺与乙酸反应的方程式为
 .
.(2)步骤②洗涤粗产品时,选用的溶剂是B.
A.热水 B.冷水
C.1:3的乙醇溶液 D.滤液
(3)步骤③两次用到过滤,其中过滤Ⅰ选择趁热过滤,是为了除去吸附有色物质的活性炭,为加快过滤速度,可采用右图所示的抽滤装置,这样做的优点是快速达到固液分离的目的,防止过滤太慢温度降低导致其他产物析出,影响产率.
(4)配制热溶液时,加入过量溶剂的作用是AB.
A.防止后续过程中,溶剂损失可能产生的产物析出
B.防止后续过程中,温度降低可能产生的产物析出
C.除去活性炭未吸附完全的有色杂质
(5)步骤③中以下哪些操作不能提高产率C.
①配制成饱和溶液后,加入过量20%的溶剂;
②趁热过滤近沸溶液;
③过滤Ⅰ时用少量沸水淋洗烧杯和漏斗中的固体,合并滤液;
④加活性炭吸附;
⑤过滤Ⅱ时的洗涤选用热水代替冷水洗涤固体.
A.①④⑤B.①④C.④⑤D.②④⑤
(6)步骤③最后测得纯乙酰苯胺固体6.75g,该实验的产率为89%(保留两位有效数字).
 在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题:
在试管a中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL浓硫酸和2mL 乙酸,按图所示,连接好装置进行实验,以制取乙酸乙酯.回答下列问题: