题目内容
15.食盐是日常生活的必需品,也是重要的化工原料.粗食盐常含有少量Ca2+、Mg2+、SO42-等杂质离子,实验室提纯NaCl的流程如图:
提供的试剂:Na2CO3溶液、K2CO3溶液、NaOH溶液、BaCl2溶液、Ba(NO3)2溶液
(1)从上述提供的试剂中选出适当的试剂除去溶液I中的Ca2+、Mg2+、SO42-离子,滴加顺序依次为NaOH、BaCl2、Na2CO3(只填化学式).
(2)操作Ⅲ的名称是蒸发结晶,所需用到的仪器主要有铁架台、酒精灯、铁圈、蒸发皿、玻璃棒(填仪器名称).
(3)加盐酸的目的是(用离子方程式表示)H++OH-=H2O、2H++CO32-=H2O+CO2↑.
分析 粗食盐加水溶解,然后加入除杂试剂,充分反应后,过滤除去沉淀,再加盐酸调节pH,最后蒸发结晶得到NaCl晶体.
(1)欲除去溶液I中的Ca2+、Mg2+、SO42-离子,可以分别采用碳酸钠、氢氧化钠、和氯化钡,根据试剂的添加原则来回答;
(2)依据蒸发结晶操作和装置分析回答;
(3)加入盐酸除去NaOH和碳酸钠.
解答 解:(1)要除去SO42-,只有选BaCl2溶液,若选用Ba(NO3)2,会引入新的离子NO3-,再选用NaOH溶液除去Mg2+溶液,最后选用Na2CO3溶液除去Ca2+,此处不能选用K2CO3溶液,否则会引入新的K+,再用HCl除去过量的CO32-,Na2CO3溶液不能加在BaCl2溶液前,否则会引入Ba2+,
故答案为:BaCl2、NaOH、Na2CO3或NaOH、BaCl2、Na2CO3;
(2)得到NaCl晶体,需要蒸发结晶操作,该装置所需用到的仪器主要有铁架台、酒精灯、铁圈、蒸发皿、玻璃棒;故答案为:蒸发结晶;蒸发皿、玻璃棒;
(3)加入盐酸除去NaOH和碳酸钠,离子方程式为H++OH-=H2O、2H++CO32-=H2O+CO2↑,
故答案为:H++OH-=H2O;2H++CO32-=H2O+CO2↑.
点评 本题考查混合物的分离和提纯,侧重考查学生分析问题、计算能力,能从整体上分析各个过程发生的反应、实验操作名称及顺序,注意容量瓶选取方法,为易错点.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
5.下列关于吸氧腐蚀和析氢腐蚀的判断正确的是( )
| A. | 吸氧腐蚀时正极放出O2 | |
| B. | 析氢腐蚀时正极放出H2 | |
| C. | 析氢腐蚀比吸氧腐蚀普遍 | |
| D. | 析氢腐蚀与吸氧腐蚀的负极反应都是Fe-3e-=Fe3+ |
3.下列物质不属于混合物的是( )
| A. | 金刚石与石墨 | B. | 冰水混合物 | C. | 胶体 | D. | 空气 |
10.在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )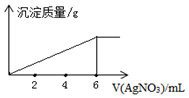

| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
7.下列气体能用向下排气法收集的有( )
| A. | NH3 | B. | H2 | C. | HCl | D. | CO |
5.下列物质必须隔绝空气密封保存的是( )
①Na ②镁条 ③石灰水④NaOH ⑤Na2CO3•10H2O ⑥NaCl.
①Na ②镁条 ③石灰水④NaOH ⑤Na2CO3•10H2O ⑥NaCl.
| A. | ①② | B. | ①③④⑤ | C. | ①②③④ | D. | ①②①②④⑤ |