题目内容
10.在5mL0.02mol/L某金属氯化物(MCln)溶液中,滴加0.05mol/L AgNO3溶液,生成沉淀质量与加入AgNO3溶液体积关系如图所示,则该氯化物中金属元素的化合价为( )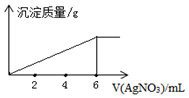
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
分析 根据化学式知,某金属氯化物(MCln)溶液中n(Cl-)=0.02mol/L×0.005L×n=10-4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl-)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,据此计算金属元素化合价.
解答 解:根据化学式知,某金属氯化物(MCln)溶液中n(Cl-)=0.02mol/L×0.005L×n=10-4 mol,当二者完全完全反应时消耗的硝酸银溶液体积为6mL,此时n(Cl-)=n(Ag+)=n(AgNO3)=0.05mol/L×0.006L=0.0003mol,则n=3,则该化合物化学式为MCl3,则M化合价为+3价,
故选C.
点评 本题考查化学方程式计算,为高频考点,侧重考查学生分析计算能力,明确发生的反应及各个物理量之间的关系式是解本题关键,题目难度不大.

练习册系列答案
相关题目
1.下列反应的离子方程式正确的是( )
| A. | 用石墨作电极电解AlC13溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 酸性高锰酸钾溶液与H2O2溶液混合:2MnO4-+3H2O2+6H+═2Mn2++4 O2↑+6H2O | |
| C. | 向NaHSO4溶液中滴加Ba(OH)2溶液至不再产生沉淀:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 向Fe(NO3)2和NaBr混合溶液中滴加稀盐酸:6Br -+2NO3-+8H+═3Br2+2NO↑+4H2O |
5.某溶液中有Ba2+、Mg2+、Ag+,现用①KOH溶液,②K2SO4溶液,③KCl溶液,将三种离子逐一沉淀并分离的过程中,用到的分离方法及次数分别是( )
| A. | 洗涤,2次 | B. | 过滤,2次 | C. | 分液,3次 | D. | 过滤,3次 |
2.下列有机反应属于加成反应的是( )
| A. | CH4+Cl2 $\stackrel{光照}{→}$ CH3Cl+HCl | B. | CH2═CH2+Br2→CH2BrCH2Br | ||
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | D. | 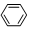 +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$ +HNO3$→_{50~60℃}^{浓H_{2}SO_{4}}$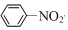 +H2O +H2O |
19.下列事实与胶体的性质无关的是( )
| A. | “尿毒症”患者做血液透析治疗 | |
| B. | FeCl3溶液中滴入NaOH溶液出现红褐色沉淀 | |
| C. | 在河流入海处易形成沙洲 | |
| D. | 在豆浆中加入盐卤制豆腐 |
20.下列有关实验装置或原理正确的是( )


| A. | 利用图1装置可定量测定H2O2的分解速率 | |
| B. | 图2中E1表示使用催化剂后的反应热 | |
| C. | 图3表示在平衡体系FeCl3+3KSCN?Fe(SCN)3+3KCl的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图象 | |
| D. | 图4表示弱电解质在水中建立电离平衡的过程 |

