��Ŀ����
6����������Դ�ǽ��������Ⱦ����Ҫ�ٴ룬���м״������������ʵ����ȼ�ϣ�������ȼ�ϵ�أ�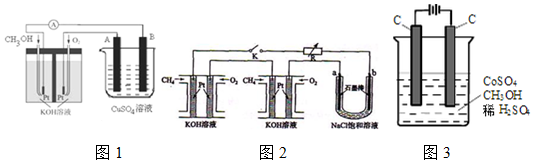
��1����֪��
��2CH3OH��l��+3O2��g��=2CO2��g��+4H2O��g����H1=-1274.0kJ/mol
��2CO��g��+O2��g��=2CO2��g����H2=-566.0kJ/mol ��H2O��g��=H2O��l����H3=-44kJ/mol�� �״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H1=-442.0kJ/mol��
��2�������ü״�ȼ�շ�Ӧ���һ��ȼ�ϵ�أ���ͼ1����Pt���缫���ϣ�������������Һ���������Һ���������缫�Ϸֱ����״���������
��д��ȼ�ϵ�ظ����ĵ缫��ӦʽCH3OH-6e-+8OH-=CO32-+6H2O��
�������ø�ȼ�ϵ���ṩ��Դ����ͼ2�ұ��ձ������������������ͭ��������Ӧ��B�����A����B����������������������6.4gʱ��ȼ�ϵ�������������ı�״�������Ϊ1.12L��
��3��ij�о�С�齫��������ȼ�ϵ�ش�������Ϊ��Դ�����б����Ȼ�����Һ���ʵ����ÿ����ؼ���ͨ����Ϊ1L����״�������ҷ�Ӧ��ȫ����������ͨ�����صĵ���Ϊ3.45��104C�������ڳ���F=9.65��l04C/mol��������ܲ������������Ϊ4 L����״������
��4����ⷨ�������״���ˮ����ɵ���Ⱦ��ԭ���ǣ�ͨ�罫Co2+������Co3+��Ȼ�״�������CO2��H+����ʯīϩ��ȥCo2+��������ͼ3��ʾװ��ģ���������̣���Co2+�������ĵ缫��ӦʽΪCo2+-e-=Co3+����6Co2+-6e-=6Co3+��
��ȥ�״������ӷ���ʽΪ6Co3++CH3OH+H2O=6Co2++CO2��+6H+��
���� ��1�������Ȼ�ѧ����ʽ���ø�˹���ɼ��㷴Ӧ�Ȳ���д�Ȼ�ѧ����ʽ����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1274.0kJ/mol
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ/mol
��H2O��g���TH2O��l����H3=-44kJ/mol��
���ݸ�˹���ɼ��㣨��-��+�ۡ�4����$\frac{1}{2}$�õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽ��
��2����ȼ�ϵ�ظ�������ȼ��ʧ���ӵ�������Ӧ���ݴ���д������Ӧ�ĵ缫��Ӧʽ��
�����ݵ��ԭ�����������ƽ������������Դ�����������Ʋ�������������Դ�������������Ʋ�������ӵĵ������Һ�����ݵ缫��Ӧ�͵����غ����õ���
��3�����ݹ�ϵʽ1 mol CH4��8 mol e-��4 mol Cl2���㣻
��4��ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+��ԭ���غ������غ��֪����ԭ����H+����ƽ��дΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
��� �⣺��1����֪����2CH3OH��l��+3O2��g���T2CO2��g��+4H2O��g����H1=-1274.0kJ/mol
��2CO��g��+O2��g���T2CO2��g����H2=-566.0kJ/mol
��H2O��g���TH2O��l����H3=-44kJ/mol��
���ݸ�˹���ɼ��㣨��-��+�ۡ�4����$\frac{1}{2}$�õ��״�����ȫȼ������һ����̼��Һ̬ˮ���Ȼ�ѧ����ʽΪ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442KJ/mol��
�ʴ�Ϊ��CH3OH��l��+O2��g��=CO��g��+2H2O��l����H=-442KJ/mol��
��2����ȼ�ϵ�ظ�������ȼ��ʧ���ӵ�������Ӧ��������Ӧ�ĵ缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O���ʴ�Ϊ��CH3OH-6e-+8OH-=CO32-+6H2O��
�����ø�ȼ�ϵ���ṩ��Դ����ͼ1�ұ��ձ������������������ͭ�������������ص��������������Դ�������ӣ�װ��ͼ����״�������B�缫������������������������6.4gʱ��Cu2++2e-=Cu������ת��0.2mol��ȼ�ϵ�������������ĵ缫��ӦΪ��O2+2H2O+4e-=4OH-�����ݵ����غ���������������ʵ���0.05mol����״�������=0.05mol��22.4L/mol=1.12L��
�ʴ�Ϊ��B��1.12��
��3�����ݵ�ʧ�����غ㣬�ɵã�1 mol CH4��8 mol e-��4 mol Cl2������ÿ����ؼ���ͨ����Ϊ1 L����״����������4L Cl2������ͨ���ĵ���Ϊ$\frac{1L}{22.4L/mol}$��8��9.65��l04C•mol-1=3.45��104C��������Ȼ������ȼ�ϵ�أ������ӵĴ�����ֻ����һ���صļ��������㣩
�ʴ�Ϊ��3.45��104C��4��
��4����ͨ���Co2+������Co3+������������ʧ���ӷ���������Ӧ���缫��ӦΪCo2+-e-=Co3+���ʴ�Ϊ��Co2+-e-=Co3+��
����Co3+����������ˮ�еļ״�������CO2����������������ԭΪCo2+�����ԭ���غ������غ��֪����ԭ����H+����ƽ��д���ӷ���ʽΪ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+���ʴ�Ϊ��6Co3++CH3OH+H2O=CO2��+6Co2++6H+��
���� ���⿼���Ȼ�ѧ���绯ѧ��ԭ�������ӷ���ʽ����д��֪ʶ��ѧ��Ҫ����ԭ��صķ�Ӧԭ���ǽⱾ��Ĺؼ�����Ŀ�Ѷ��еȣ�

| A�� | �ڷ�ӦKClO3+6HCl=KCl+3Cl2��+3H2O�У����õ���״����67.2 L Cl2ʱ����Ӧ��ת�Ƶĵ�����Ϊ6 NA | |
| B�� | 6.0 g SiO2�����к��еĹ�������ĿΪ0.2 NA | |
| C�� | ��״���£�22.4 L NO��11.2 L O2��Ϻ�����ķ�������ΪNA | |
| D�� | S2��S8�Ļ���ﹲ6.4 g������������ԭ����һ��Ϊ0.2 NA |
| A�� | ��̬���� | B�� | ������Ԫ�ص����� | ||
| C�� | Һ̬���� | D�� | û����ɫ����Һ |
| A�� | ��ʯī���缫���AlC13��Һ��2Cl-+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$Cl2��+H2��+2OH- | |
| B�� | ���Ը��������Һ��H2O2��Һ��ϣ�2MnO4-+3H2O2+6H+�T2Mn2++4 O2��+6H2O | |
| C�� | ��NaHSO4��Һ�еμ�Ba��OH��2��Һ�����ٲ���������Ba2++OH-+H++SO42-�TBaSO4��+H2O | |
| D�� | ��Fe��NO3��2��NaBr�����Һ�еμ�ϡ���6Br -+2NO3-+8H+�T3Br2+2NO��+4H2O |

