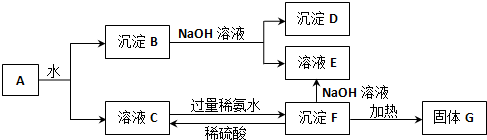
题目内容
12.下列关于说法不正确的是( )| A. | 二氧化硫能使浸过酸性高锰酸钾溶液的滤纸褪色说明二氧化硫具有漂白性 | |
| B. | 将收集满二氧化氮气体的试管倒立在水中,水会充满试管 | |
| C. | 氨气可以做喷泉实验,这是利用氨气极易溶于水的性质 | |
| D. | 在实验室中,不能利用稀硝酸与锌粒反应制氢气 |
分析 A.褪色发生了氧化还原反应;
B.二氧化氮与水反应生成的NO不溶于水;
C.氨气极易溶于水;
D.硝酸具有强氧化性.
解答 解:A.二氧化硫能使浸过酸性高锰酸钾溶液的滤纸褪色,发生了氧化还原反应,可知二氧化硫具有还原性,与漂白性无关,故A错误;
B.二氧化氮与水反应生成的NO不溶于水,则水不能充满试管,故B错误;
C.氨气极易溶于水,则氨气可以做喷泉实验,故C正确;
D.硝酸具有强氧化性,与金属反应生成硝酸盐、氮的氧化物、水,则不能利用稀硝酸与锌粒反应制氢气,故D正确;
故选AB.
点评 本题考查物质的性质及氧化还原反应,为高频考点,把握物质的性质、发生的反应和现象是解答该题的关键,注意元素化合物知识的综合应用,题目难度不大.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
2.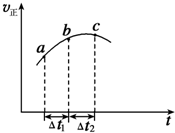 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
 向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)
向绝热恒容密闭容器中通入SO2和NO2一定条件下使反应SO2(g)+NO2(g)?SO3(g)+NO(g)达到平衡,正反应速率随时间变化的示意图如图所示,
由图可得出的不正确结论是( )
| A. | 反应在C点达到平衡状态 | |
| B. | 反应物的总能量大于生成物的总能量 | |
| C. | 反应物浓度:a点大于b点 | |
| D. | △t1=△t2时,SO2的转化率:a~b段小于b~c段 |
3.今有一混合物的水溶液,含有以下离子中的若干种:Na+、CO32-、Cl-、Ba2+、NH4+、SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液,加热,收集到标准状况下的气体448mL(提示:NH4++OH-=NH3↑+H2O)
(3)第三份加足量Ba(NO3)2溶液,得沉淀4.30g,再用足量硝酸洗涤、干燥后,沉淀质量为2.33g.根据上述实验,下列推测不正确的是( )
| A. | 该溶液中.Na+一定存在,且浓度为0.1mol/L | |
| B. | 该溶液中CO32-和SO42-一定存在,且物质的量浓度均为0.1mol/L | |
| C. | Ba2+一定不存在 | |
| D. | NH4+ 一定存在,且100mL溶液中物质的量为0.02mol |
7.下列有关叙述正确的是( )
| A. | 升高温度,可以使纯水中的c(H+)>c(OH-) | |
| B. | 在NaOH溶液中没有H+,在HCl溶液中没有OH- | |
| C. | 水的电离过程是一个吸热过程 | |
| D. | 将水加热,KW增大,pH不变 |
17.下列除去杂质的方法不 正确的是( )
| A. | 用过量烧碱溶液除去镁粉中混有少量铝粉 | |
| B. | 用过量氨水除去Fe3+溶液中的少量Al3+ | |
| C. | 用加热方法除去Na2CO3中混有少量NaHCO3 | |
| D. | 用过量氢氧化钠溶液除去MgO中的少量Al2O3 |
1.化学与生活密切相关.下列生活中常见物质的俗名与化学式相对应的是( )
| A. | 纯碱-NaHCO3 | B. | 胆矾-CuSO4 | C. | 醋酸-CH3COOH | D. | 生石灰-CaCO3 |
 已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题:
已知X、Y和Z三种元素的原子序数之和等于42.X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子.X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子.请回答下列问题: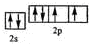 ;
;