题目内容
10.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
分析 由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,然后利用元素及其单质、化合物的性质来解答.
解答 解:由元素在周期表中的位置可知,A为H,B为Na,C为Al,D为C,E为N,F为P,G为F,H为Cl,I为Ne,
(1)F的非金属性最强,则F2的氧化性最强,Na的金属性最强,单质的还原性最强,故答案为:F;F2;Na;
(2)Na的金属性最强,则最高价氧化物的水化物NaOH的碱性最强,Cl的最高价氧化物的水化物的酸性最强,上述元素中的最高价氧化物的水化物中只有Al(OH)3为两性,故答案为:NaOH; HClO4;Al(OH)3;
(3)N、Cl、F中F的非金属性最强,则HF最稳定,故答案为:HF;
(4)非金属性N>P>C,非金属性越强,对应的最高价氧化物的水化物的酸性越强,为HNO3>H3PO4>H2CO3,故答案为:HNO3>H3PO4>H2CO3.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素化合物知识为解答的关键,注意元素周期律的应用及氢氧化铝的两性,侧重分析与推断能力的考查,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Y-电子数之差为8.下列推测不正确的是( )
| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
5.下列金属是通过电解法冶炼的是( )
| A. | 镁 | B. | 铁 | C. | 铜 | D. | 银 |
15.氮的固定是几百年来科学家一直研究的课题.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
①分析数据可知:大气固氮反应属于吸热(填“吸热”或“放热”)反应.
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
(1)下表列举了不同温度下大气固氮和工业固氮的部分K值.
| 反应 | 大气固氮 N2(g)+O2(g)?2NO(g) | 工业固氮 N2(g)+3H2(g)?2NH3(g) | |||
| 温度/℃ | 27 | 2000 | 25 | 400 | 450 |
| K | 3.84×10-31 | 0.1 | 5×108 | 0.507 | 0.152 |
②分析数据可知:人类不适合大规模模拟大气固氮的原因K值小,正向进行的程度小(或转化率低),不适合大规模生产.
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因从反应速率角度考虑,高温更好,但从催化剂活性等综合因素考虑选择500℃左右合适.
(2)工业固氮反应中,在其他条件相同时,分别测定N2的平衡转化率在不同压强(р1、р2)下随温度变化的曲线,如图所示的图示中,正确的是A(填“A”或“B”);比较р1、р2的大小关系р2>р1.

(3)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现高温常压下的电化学合成氨,提高了反应物的转化率,其实验简图如C所示,阴极的电极反应式是N2+6e-+6H+=2NH3.
(4)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:2N2(g)+6H2O(l)?4NH3(g)+3O2(g),则其反应热△H=+1530kJ•mol-1.
已知:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1
2H2(g)+O2(g)?2H2O(l)△H=-571.6kJ•mol-1.
17.某化学反应的能量变化如图所示.下列有关叙述正确的是( )
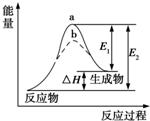

| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
17.下列物质中,化学式能真正表示该物质分子组成的是( )
| A. | Na2O | B. | SiO2 | C. | KCl | D. | H2SO4 |
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.