题目内容
17.某化学反应的能量变化如图所示.下列有关叙述正确的是( )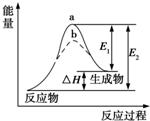
| A. | 该反应为吸热反应,△H=E1-E2 | |
| B. | 使用催化剂,△H减小 | |
| C. | 使用催化剂,可以改变化学平衡常数 | |
| D. | 如图可知b使用了催化剂,反应速率加快 |
分析 A.根据图象分析可知反应物能量低于生成物能量,为吸热反应;
B.加入催化剂会降低反应的活化能,加快反应速率,不改变化学平衡,反应焓变和起始终了物质能量有关和变化过程无关;
C.加入催化剂不会改变化学反应平衡;
D.催化剂能降低反应的活化能,从而加快化学反应速率.
解答 解:A.焓变△H=E2-E1,反应为吸热反应,故A错误;
B.催化剂会降低反应的活化能,不改变化学平衡,反应焓变△H不变,故B错误;
C.加入催化剂不会改变化学反应的平衡,化学平衡常数不变,故C错误.
D.催化剂能降低反应的活化能,b使用了催化剂从而加快化学反应速率,故D正确;
故选D.
点评 本题考查了反应能量变化的分析判断,图象分析是解题关键,反应的能量守恒是判断的依据,注意加入催化剂不会改变化学平衡,会降低反应的活化能,题目较简单.

练习册系列答案
相关题目
9.下列说法中,正确的是( )
| A. | 由分子构成的物质中一定含有共价键 | |
| B. | 形成共价键的元素不一定是非金属元素 | |
| C. | 正四面体结构的分子中的键角一定是109°28′ | |
| D. | ClO2-的空间构型为直线型 |
10.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
7.甲醛、乙醛、丙酸(C3H6O2)、丁烯、环氧乙烷(C2H4O)的混合物中,测得H的质量分数为9%,则混合物中O的质量分数为( )
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 无法确定 |
14.化学与能源开发、环境保护、资源利用及日常生活等密切相关,下列说法正确的是( )
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| C. | PM2.5主要来自于煤和石油等化石燃料的燃烧 | |
| D. | 汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的△H>O |
1.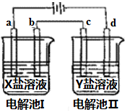 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
 如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )
如图所示的电解池I和II中,a、b、c和d均为Pt电极.电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b<d.符合上述实验结果的盐溶液是( )| 选项 | X | Y |
| A | MgSO4 | CuSO4 |
| B | AgNO3 | KNO3 |
| C | FeSO4 | Al2(SO4)3 |
| D | CuSO4 | AgNO3 |
| A. | A | B. | B | C. | C | D. | D |
8.有机物分子中原子间(或原子与原子团间)的相互影响会导致物质化学性质的不同.下列各项的事实不能说明上述观点的是( )
| A. | 甲烷不能使酸性高锰酸钾溶液褪色,而甲苯能使酸性高锰酸钾溶液褪色 | |
| B. | 乙醇能发生消去反应,而乙烷不能发生消去反应 | |
| C. | 苯与硝酸在加热的条件下发生取代反应,而甲苯在常温下就能与硝酸发生硝化反应 | |
| D. | 乙烷在光照条件下能发生取代反应,而乙炔不能发生取代反应 |
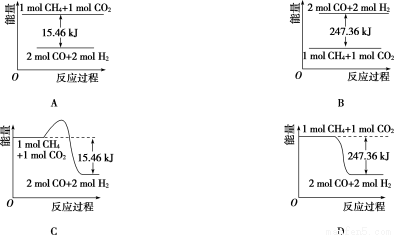
 O、H2)
O、H2)