题目内容
5.下列金属是通过电解法冶炼的是( )| A. | 镁 | B. | 铁 | C. | 铜 | D. | 银 |
分析 金属的活泼性不同采用不同的方法,金属的冶炼一般有电解法、热还原法、热分解法、物理分离法.
电解法:冶炼活泼金属K、Ca、Na、Mg、Al,一般用电解熔融的氯化物(Al是电解熔融的三氧化二铝)制得;
热还原法:冶炼较不活泼的金属Zn、Fe、Sn、Pb、Cu,常用还原剂有(C、CO、H2等);
热分解法:Hg、Ag用加热分解氧化物的方法制得;
物理分离法:Pt、Au用物理分离的方法制得;
依据金属的活泼性判断解答.
解答 解:A.镁性质活泼,一般采用电解法制取,故A正确;
B.铁性质较不活泼,通常采用热还原法制取,故B错误;
C.铜性质较不活泼,通常采用热还原法制取,故C错误;
D.银性质不活泼,通常采用热分解法制取,故D错误;
故选:A.
点评 本题考查了金属冶炼方法,明确金属的活泼性是解题关键,注意对不同类型金属冶炼方法的归纳总结.

练习册系列答案
相关题目
17.信息时代给人们的生活带来了极大的便利,但同时也产生了大量的电子垃圾.某化学兴趣小组将一批废弃的线路板简单处理后,得到了主要含Cu、Al及少量Fe、Au等金属的混合物,并设计了如下制备硫酸铜晶体和硫酸铝晶体的路线:部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
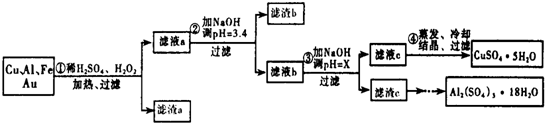
(1)过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒.
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mLNa2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.

| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |
(2)Cu可溶于稀硫酸与H2O2的混合溶液,其离子方程式是Cu+H2O2+2H+═Cu2++2H2O
(3)滤渣a的主要成分是Au.
(4)步骤③中X的取值范围是5.2≤X<5.4.
(5)为了测定硫酸铜晶体的纯度,该组甲同学准确称取4.0g样品溶于水配成100mL溶液,取10mL溶液于带塞锥形瓶中,加适量水稀释,调节溶液pH=3~4,加入过量的KI和淀粉指示剂,用0.1000mol•L-1Na2S2O3标准溶液滴定至终点.共消耗14.00mLNa2S2O3标准溶液.上述过程中反应的离子方程式如下:
2Cu2++4I-=2CuI(白色)↓+I2
2S2O32-+I2=2I-+S4O62-
①样品中硫酸铜晶体的质量分数为87.5%.
②该组乙同学提出通过直接测定样品中SO42-的量也可求得硫酸铜晶体的纯度,老师审核后予以否决,其原因是样品中含有Na2SO4等杂质.
(6)请你设计一个由滤渣c得到Al2(SO4)3•18H2O的实验方案将滤渣c加入稀硫酸溶解,然后蒸发、浓缩、冷却、结晶、过滤得到Al2(SO4)2•18H2O晶体.
16.向盛有硫酸铜水溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色的透明溶液.下列对此现象说法正确的是( )
| A. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 | |
| B. | 沉淀溶解后,将生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| C. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| D. | 向反应后的溶液加入乙醇,溶液没有发生变化 |
13.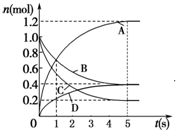 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2 D?3B+4C | |
| B. | 反应进行到1 s时,v(A)=v(B) | |
| C. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| D. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) |
10.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
17.下列物质中,既含有离子键又含有共价键的是( )
| A. | CO2 | B. | Na2O | C. | MgBr2 | D. | NH4Cl |
14.化学与能源开发、环境保护、资源利用及日常生活等密切相关,下列说法正确的是( )
| A. | 乙醇和汽油都是可再生能源,应大力推广使用乙醇汽油 | |
| B. | 凡含有食品添加剂的食物对人体健康均有害,不宜食用 | |
| C. | PM2.5主要来自于煤和石油等化石燃料的燃烧 | |
| D. | 汽车尾气中的一氧化氮遇空气在低温下能自发进行反应,说明该反应的△H>O |
12.当X-0-H型化合物而言,X是除去H、0外的其他元素,下列各说法中,不正确的( )
| A. | 当X是活泼的金属时,它一定是强碱 | |
| B. | X是得电子能力很强的非金属元素,X-0-H一定为酸 | |
| C. | X-0-H的水溶液不能导电 | |
| D. | X-0-H不可能是直线形的 |