题目内容
18.元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Y-电子数之差为8.下列推测不正确的是( )| A. | 同周期元素中X的金属性最强 | |
| B. | 原子半径X>Y,离子半径X+>Y- | |
| C. | 同族元素中Z的氢化物稳定性最高 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
分析 元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Y-电子数之差为8,则X为Na元素,Y为Cl元素,Z的原子序数为36-11-17=8,所以Z为O元素,结合元素周期律的递变规律解答该题.
解答 解:元素X、Y、Z的原子序数之和为36,X、Y在同一周期,X+与Y-电子数之差为8,则X为Na元素,Y为Cl元素,Z的原子序数为36-11-17=8,所以Z为O元素,则
A.X为Na元素,同周期元素从左到右元素的金属性逐渐减弱,则Na的金属性最强,故A正确;
B.同周期元素从左到右元素的原子半径逐渐减小,则原子半径X>Y,电子层数越多,离子半径越大,所以离子半径X+<Y-,故B错误;
C.Z的氢化物为H2O,Z位于同族的最上方,根据元素周期律,同族元素中Z的氢化物稳定性最高,故C正确;
D.Y为Cl,同周期元素从左到右元素的非金属性逐渐增强,对应的最高价氧化物的水化物的酸性逐渐增强,故D正确.
故选B.
点评 本题考查元素的推断和元素周期律,题目难度中等,注意把握元素的推断的角度以及元素周期律的递变规律.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
11.相同质量的下列烃,完全燃烧时,需要氧气最少的是( )
| A. | CH4 | B. | C2H4 | C. | C3H6 | D. | C2H2 |
9.下列说法中,正确的是( )
| A. | 由分子构成的物质中一定含有共价键 | |
| B. | 形成共价键的元素不一定是非金属元素 | |
| C. | 正四面体结构的分子中的键角一定是109°28′ | |
| D. | ClO2-的空间构型为直线型 |
6.已知汽车尾气无害化处理反应为2NO(g)+2CO(g)?N2(g)+2CO2(g)△H<0下列说法不正确的是( )
| A. | 升高温度可使该反应的逆反应速率降低 | |
| B. | 反应达平衡后,CO的反应速率保持不变 | |
| C. | 使用高效催化剂可有效提高正、逆反应速率 | |
| D. | 单位时间内消耗CO和N2的物质的量之比为2:1时,反应达到平衡 |
13.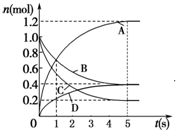 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
 一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )
一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )| A. | 该反应的化学方程式为6A+2 D?3B+4C | |
| B. | 反应进行到1 s时,v(A)=v(B) | |
| C. | 反应进行到5 s时,B的平均反应速率为0.06mol/(L•s) | |
| D. | 反应进行到5 s时,v(A)=v(B)=v(C)=v(D) |
3.下列电离方程式书写正确的是( )
| A. | 把CaO放入水中:CaO═Ca2++O2- | |
| B. | 加热NaHSO4至熔化:NaHSO4═Na++H++SO42- | |
| C. | 把Al2(SO4)3放入水中:Al2(SO4)3═Al3++SO42- | |
| D. | 把NaCl放入水中:NaCl═Na++Cl- |
10.下表是周期表中的一部分,根据A-I在周期表中的位置,用元素符号或化学式回答下列问题:
(1)表中元素,化学性质最不活泼的是,只有负价而无正价的是F,氧化性最强的单质是F2,还原性最强的单质是Na;
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
(2)最高价氧化物的水化物碱性最强的是NaOH,酸性最强的是HClO4,呈两性的是Al(OH)3;
(3)A分别与D、E、F、G、H形成的化合物中,最稳定的HF;
(4)从大到小排列D、E、F最高价氧化物对应水化物的酸性强弱HNO3>H3PO4>H2CO3.
7.甲醛、乙醛、丙酸(C3H6O2)、丁烯、环氧乙烷(C2H4O)的混合物中,测得H的质量分数为9%,则混合物中O的质量分数为( )
| A. | 0.37 | B. | 0.24 | C. | 0.16 | D. | 无法确定 |