题目内容
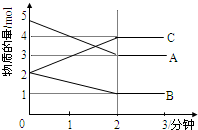 某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是
某可逆反应从0-2分钟进行过程中,在不同反应时间各物质的量的变化情况如图所示.则该反应的反应物是考点:化学平衡建立的过程
专题:化学平衡专题
分析:根据物质的量的变化判断反应物和生成物,各物质的物质的量的变化量之比等于反应中各物质的计量数之比,写出化学方程式;
化学反应速率是单位时间内浓度的变化,据此判断;
当物质的物质的量不再变化,反应达到平衡状态.
化学反应速率是单位时间内浓度的变化,据此判断;
当物质的物质的量不再变化,反应达到平衡状态.
解答:
解:由图可知,在2min时,A的物质的量减小5mol-3mol=2mol,B的物质的量减小2mol-1mol=1mol,A、B为反应物,C的物质的量增加4mol-2mol=2mol,C为生成物,根据反应中的计量数之比等于变化的物质的物质的量之比,要写出反应方程式为:2A+B?2C;
由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率;故答案为:不能;无体积,无法求出浓度变化值;
随反应进行进行2min后A、B、C物质的量不变,说明反应达到平衡状态;
故答案为:A、B;C;2A+B?2C;不能;无体积,无法求出浓度变化值;能.
由于不能确定溶液的体积,则不能计算浓度的变化,无法计算反应速率;故答案为:不能;无体积,无法求出浓度变化值;
随反应进行进行2min后A、B、C物质的量不变,说明反应达到平衡状态;
故答案为:A、B;C;2A+B?2C;不能;无体积,无法求出浓度变化值;能.
点评:本题考查化学平衡图象问题,题目难度不大,注意把握由图象判断化学方程式的方法,注意反应速率的计算公式是浓度的变化.

练习册系列答案
相关题目
25℃某气态烃与氧气混合充入密闭容器中,点火爆炸后又恢复到25℃,此时容器内压强为开始时的一半,再经氢氧化钠溶液处理,容器内几乎为真空,该烃的分子式为( )
| A、C2H4 |
| B、C3H6 |
| C、C2H6 |
| D、C5H12 |
 如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )
如图是恒温下化学反应“A(g)+B(g)?C(g)”的反应速率随反应时间变化的示意图,下列叙述与示意图符合的是( )| A、平衡态Ⅰ与平衡态Ⅱ的正反应速率相等 |
| B、平衡移动的原因可能是增大了反应物浓度 |
| C、平衡移动的原因可能是增大了压强 |
| D、平衡状态Ⅰ和平衡状态Ⅱ的平衡常数的大小关系为K1<K2 |
在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g) 达到平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数( )
| A、不变 | B、增大 |
| C、减小 | D、无法判断 |
下列有关离子的检验方法,正确的是( )
| A、向某溶液加入硫酸酸化的氯化钡溶液,以检验SO42-的存在 |
| B、向某溶液中滴加浓氨水,以检验Al3+的存在 |
| C、用铂丝蘸取某溶液在火焰上灼烧,直接观察火焰颜色,以检验K+的存在 |
| D、向某溶液中加入稀硝酸酸化的硝酸银溶液,以检验Cl-的存在 |
下列关于药物的使用,说法正确的是( )
| A、“是药三分毒”,必须按医嘱或药物说明书使用药物,防范不良反应 |
| B、使用青霉素时,直接静脉注射,可以不用进行皮肤敏感试验 |
| C、长期大量使用阿司匹林可预防疾病,没有副作用 |
| D、对于标记“OTC”的药物,必须持有医生的处方才能购买 |
下列叙述中正确的是( )
| A、化学反应一定有物质变化,不一定有能量变化 |
| B、化合反应一定是放热反应 |
| C、放热反应不需要加热就一定能发生 |
| D、吸热反应不加热也可能发生 |