题目内容
11. 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
(2)该反应的平衡常数表达式为K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.能说明该反应已达到平衡状态的是ABC.
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是C.
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是1<$\frac{a}{b}$<3.
分析 (1)根据v=$\frac{△c}{△t}$计算0~4s内v(NO),再利用速率之比等于化学计量数之比计算0~4s内v(O2),根据v=$\frac{△c}{△t}$计算1~5s内v(NO),然后进行比较判断;
(2)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比;可逆反应到达平衡时,同种物质的正逆速率相等,各组分的浓度、含量保持不变,由此衍生的其它一些量不变,判断平衡的物理量应随反应进行发生变化,该物理量由变化到不变化说明到达平衡;
(3)已知:K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,增大反应物浓度、使用催化剂均可以加快反应速率,增大反应物浓度,平衡正向移动,但使用催化剂不影响平衡移动,分离出生成物,使平衡正向移动,但反应速率会减慢;
(4)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则(a-2x+b-x):2x=1:2,即a+b=4x,结合x<b及2x<a进行解答.
解答 解:(1)0~4s内v(NO)=$\frac{(0.020-0.006)mol}{\frac{2L}{4s}}$=0.00175mol/(L.s),速率之比等于化学计量数之比,则0~4s内v(O2)=$\frac{1}{2}$v(NO)=0.000875mol/(L.s),1~5s内v(NO)=$\frac{\frac{(0.010-0.006)mol}{2L}}{4s}$=0.0005mol/(L.s),故0~4s内以O2浓度变化表示的正反应速率大于1~5s内以NO浓度变化表示的正反应速率,
故答案为:大于;
(2)2NO(g)+O2(g)?2NO2(g)的平衡常数表达式K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;A.气体颜色不再变化,说明二氧化氮的浓度不变,反应到达平衡,故A正确; B.混合气体的质量始终不变,气体的总物质的量不确定,当气体平均相对分子质量保持不变,说明随反应进行容器内混合气体物质的量不变,此时为平衡状态,故B正确;C.由于υ逆(NO)=2υ逆(O2),而υ逆(NO)=2υ正(O2),则υ逆(O2)=υ正(O2),反应到达平衡,故C正确;D.混合气体总质量不变,容器容积不变,容器内密度始终保持不变,故D错误,故选:ABC;
故答案为:$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$;ABC;
(3)A.适当升高温度,反应速率加快,由K300℃>K350℃,说明升高温度平衡常数减小,平衡逆向移动,故A错误;
B.充入Ar使压强增大,但不改反应物和生成物的浓度,反应速率不变,平衡不移动,故B错误;
C.增大O2的浓度,反应速率加快,平衡正向移动,故C正确;
D.选择高效催化剂,加快反应速率,但不影响平衡移动,故D错误,
故答案为:C;
(4)假设转化的氧气为xmol,则:
2NO(g)+O2(g)?2NO2(g)
起始量(mol):a b 0
转化量(mol):2x x 2x
平衡量(mol):a-2x b-x 2x
则(a-2x+b-x):2x=1:2,即a+b=4x,由于x<b,联立可得$\frac{a}{b}$<3,又由于2x<a,联立可得$\frac{a}{b}$>1,则1<$\frac{a}{b}$<3,
故答案为:1<$\frac{a}{b}$<3.
点评 本题考查化学平衡计算与影响因素、反应速率计算、平衡状态判断等,(4)中注意充分利用可逆反应不能完全反应进行分析解答,难度中等.

 一线名师提优试卷系列答案
一线名师提优试卷系列答案 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案| A. | 6种 | B. | 9种 | C. | 12种 | D. | 15种 |
| A. | BaO2的水解产物是Ba(OH)2和H2O2 | B. | PCl3水解的产物是HClO和PH3 | ||
| C. | CaC2水解的产物是Ca(OH)2和C2H2 | D. | Al2S3水解的产物是Al(OH)3和H2S |
| A. | ②③⑤ | B. | ②③⑦ | C. | ②③⑧ | D. | ②③⑦⑧ |
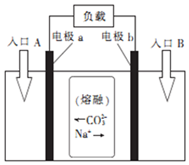 “直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )
“直接煤燃料电池”能够将煤中的化学能高效、清洁地转化为电能.用熔融Na2CO3作电解质的直接煤燃料电池的工作原理如图.下列有关说法正确的是( )| A. | 该电池的总反应为C+O2═CO2 | |
| B. | 煤直接燃烧发电比直接煤燃料电池发电的能量利用率高 | |
| C. | 进入反应室的煤块粉碎成粉末状对反应速率和限度均无影响 | |
| D. | 电子由电极b沿导线流向电极a,入口A加入的物质为煤粉 |
 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热.
根据以上所有内容回答下列问题:
(1)装置e的作用是冷凝收集产品,并防止倒吸;
(2)写出d中发生反应的化学方程式2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出'化学反应方程式CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如表):
| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
②当银氨溶液的量为lmL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为5~6.5min.(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有乙酸
(填物质名称),要除去该物质,可先在混合液中加入C(填写下列选项中的字母),然
后再通过蒸馏(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4.
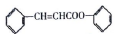 是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示:
是合成高聚酚酯的原料,其合成路线(部分反应条件略去)如图所示: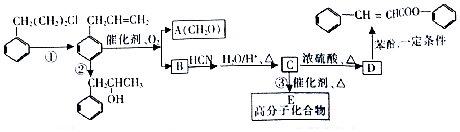
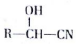 $→_{△}^{H_{2}O/H+}$
$→_{△}^{H_{2}O/H+}$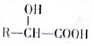
 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +nH2O.
+nH2O. (任写一种).
(任写一种).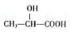 )的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)
)的路线(其他试剂任选,合成路线常用的表示方式为A$\stackrel{反应试剂}{→}$B…$\stackrel{反应试剂}{→}$目标产物)