题目内容
1. 某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.
某校化学兴趣小组的同学在完成课本乙醇制乙醛的实验后,改进了实验方案(如图)按下列顺序进行如下实验操作.①连接好仪器,检验装置的气密性;
②正确添加试剂;
③点燃C装置中的酒精灯;
④向圆底烧瓶中滴加10%过氧化氢溶液;
⑤点燃B装置中的酒精灯加热无水乙醇至沸腾并持续加热.
根据以上所有内容回答下列问题:
(1)装置e的作用是冷凝收集产品,并防止倒吸;
(2)写出d中发生反应的化学方程式2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)为检验D中收集的产物中是否含有乙醛,甲同学利用银氨溶液检验,请写出'化学反应方程式CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)该兴趣小组的同学还对乙醛进行银镜反应的最佳实验条件进行了探究(部分实验数据如表):
| 实验变量 实验序号 | 银氨溶液的S/mL | 乙醛的量/滴 | 温度/℃ | 反应混合液的pH值 | 出现银镜的时间/min |
| 1 | 1 | 3 | 65 | 11 | 5 |
| 2 | 1 | 3 | 45 | 11 | 6.5 |
| 3 | 1 | 5 | 65 | 11 | 4 |
②当银氨溶液的量为lmL,乙醛的量为3滴,温度为55℃,反应混合液pH为11时,出现银镜的时间为5~6.5min.(填范围)
(5)若试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明液体中还含有乙酸
(填物质名称),要除去该物质,可先在混合液中加入C(填写下列选项中的字母),然
后再通过蒸馏(填操作名称)即可除去.
A.饱和NaCl溶液 B.C2H5OH C.NaHCO3溶液 D.CCl4.
分析 (1)根据装置e为球形漏斗结合实验产物性质分析;
(2)乙醇的催化氧化反应实质是:金属铜被氧气氧化为氧化铜,氧化铜将乙醇氧化为乙醛,金属铜起催化剂作用;
(3)乙醛中具有还原性的醛基,被新制的银氨溶液氧化;
(4)①对比实验1和实验2,反应条件只有温度不同,故其实验目的是:比较温度不同对银镜反应的影响;
②其它条件相同,随着温度升高,反应速率加快:其它条件相同,温度为55℃的反应速率应该在温度为45℃温度为65℃之间;
(5)试管中收集到的液体用紫色石蕊试液检验,溶液显红色,说明存在酸性有机物,再乙醛的氧化产物为乙酸进行分析即可;欲除去此酸性物质,应结合酸的通性分析,选择试剂,另外再根据相互混溶的液体混合物的常见分离方式,选择分离操作.
解答 解:(1)D为乙醛,易溶于水,装置e为球形漏斗,球形部分体积大,能防止倒吸,同时冷凝收集产品,
故答案为:冷凝收集产品,并防止倒吸;
(2)乙醇的催化氧化反应过程:金属铜被氧气氧化为氧化铜,2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO,氧化铜将乙醇氧化为乙醛,CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O,
故答案为:2Cu+O2$\frac{\underline{\;加热\;}}{\;}$2CuO、CH3CH2OH+CuO$\frac{\underline{\;加热\;}}{\;}$CH3CHO+Cu+H2O;
(3)醛基能被弱氧化剂氧化为羧基,用银氨溶液检验D中官能团的化学方程式为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O,
故答案为:CH3CHO+2Ag(NH3)2OH$\stackrel{水浴}{→}$CH3COONH4+2Ag↓+3NH3+H2O;
(4)①对比实验1和实验2的反应条件,其它条件相同,只有温度不同,其实验目的是比较银镜反应中,温度不同对生成银镜的影响;
故答案为:温度对反应速率的影响;
②由实验1和实验2知:银氨溶液的量为1mL,乙醛的量为3滴,反应混合液pH为11时,水浴温度为45℃,出现银镜时间为6.5min,水浴温度为65℃,出现银镜时间为5min,其它条件相同,随着温度升高,反应速率加快,故:当银氨溶液的量为1mL,乙醛的量为3滴,水浴温度为55℃,反应混合液pH为11时,出现银镜的时间应在5min到6.5min之间,
故答案为:5~6.5;
(5)若试管中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有乙酸,四个选择答案中,只有碳酸氢钠可以和乙酸反应,生成乙酸钠、水和二氧化碳,实现两种互溶物质的分离用蒸馏法,
故答案为:乙酸;C;蒸馏.
点评 本题考查乙醇的化学性质、混合物的分离与提纯等,题目难度中等,注意掌握物质性质和实验基本操作方法是解题本题关键,明确乙醇的催化氧化原理,侧重于化学方程式的书写、乙醛进行银镜反应的最佳实验条件探究,注意银镜反应实验成功的关键因素.

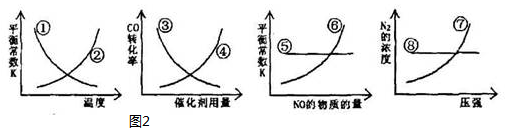
 在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).
在2L恒容密闭容器中,发生反应 2NO(g)+O2(g)?2NO2(g).(1)某温度时,按物质的量比2:1充入NO和O2开始反应,n(NO)随时间变化如表:
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)(mol) | 0.020 | 0.010 | 0.007 | 0.006 | 0.006 | 0.006 |
(2)该反应的平衡常数表达式为K=$\frac{{c}^{2}(N{O}_{2})}{{c}^{2}(NO)×c({O}_{2})}$.能说明该反应已达到平衡状态的是ABC.
A.气体颜色保持不变 B.气体平均相对分子质量保持不变
C.υ逆(NO)=2υ正(O2)D.气体密度保持不变
(3)已知:K300℃>K400℃.下列措施能使该反应的反应速率增大且平衡向正反应方向移动的是C.
A.升高温度 B.充入Ar使压强增大 C.充入O2使压强增大 D.选择高效催化剂
(4)将amolNO和bmolO2发生反应,要使反应物和生成物物质的量之比为1:2,则a/b的取值范围是1<$\frac{a}{b}$<3.
| A. | W、X、Y、Z最外层电子数之和为20 | B. | WX2、YX2和ZX2均只含共价键 | ||
| C. | 原子半径的大小顺序为X<W<Y<Z | D. | Z的气态氢化物比Y的稳定 |
| A. | 溴水、氯化铁溶液 | B. | 溴水、酸性高锰酸钾溶液 | ||
| C. | 氯化铁溶液、碳酸钠溶液 | D. | 氯化铁溶液、酸性高锰酸钾溶液 |
| A. | 该反应的反应物总能量比产物总能量低QkJ | |
| B. | 1mol S(g)与1 mol O2(g)反应,生成1 mol SO2(g),放出Q kJ的热量 | |
| C. | 在S(s)+O2(g)═SO2(g) 反应中,生成1 mol SO2(g)放出的热量大于Q KJ | |
| D. | 1个S(g)与1个O2(g) 完全反应可以放出Q KJ的热量 |
| A. | 甲烷的燃烧热为890.3KJ•mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 KJ,其热化学方程式为:N2(g)+3H2(g)$?_{500℃30MPa}^{催化剂}$ 2NH3(g)△H=-38.6 KJ•mol-1 | |
| C. | 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为: N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=-641.6 KJ•mol-1 | |
| D. | CO(g)的燃烧热是283.0 KJ•mol-1,则2CO2(g)═2CO(g)+O2(g) 反应的△H=+283.0 KJ•mol-1 |
 ,则下列物质与
,则下列物质与  互为同分异构体的是( )
互为同分异构体的是( )



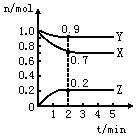 某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示.
某温度时,在2L密闭容器中X、Y、Z三种物质的量随时间的变化曲线如图所示. 2Z.
2Z.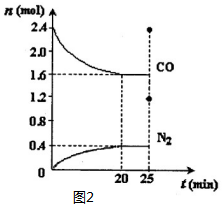 对含氮物质的研究和利用有着极为重要的意义.
对含氮物质的研究和利用有着极为重要的意义.