题目内容
17.利用如图所示装置进行下列实验,根据现象能得出相应实验结论的是( )| ①中的反应物 | ②中的现象 | 实验结论 | 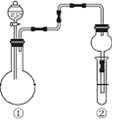 | |
| A | 纯碱、稀硫酸 | 硅酸钠溶液中出现白色沉淀 | 酸性:硫酸>碳酸>硅酸 | |
| B | MnO2、浓盐酸 | 淀粉KI溶液变蓝 | Cl2有氧化性 | |
| C | Na2SO3、硫酸 | 溴水褪色 | SO2有漂白性 | |
| D | Cu、硝酸 | 红棕色气体 | ①中硝酸为浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.发生强酸制取弱酸的反应;
B.MnO2与浓盐酸反应生成氯气,需要加热;
C.生成的二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr;
D.Cu与稀硝酸反应生成NO,NO被空气氧化生成红棕色的气体.
解答 解:A.发生强酸制取弱酸的反应,由现象可知酸性:硫酸>碳酸>硅酸,故A正确;
B.MnO2与浓盐酸反应生成氯气,需要加热,则图中装置不能制备氯气,故B错误;
C.生成的二氧化硫与溴水发生氧化还原反应,生成硫酸和HBr,S元素的化合价升高,则二氧化硫具有还原性,故C错误;
D.Cu与稀硝酸反应生成NO,NO被空气氧化生成红棕色的气体,装置中含空气,则硝酸可能为稀硝酸或浓硝酸,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握酸性比较、物质的制备、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意化学实验方案的评价,题目难度不大.

练习册系列答案
相关题目
7.下列说法正确的是( )
| A. | 水库中的钢闸门通常连接锌块,是采用了牺牲阳极的阴极保护法 | |
| B. | 化学电源都是一次能源 | |
| C. | 铁的表面镀铜的过程中,铜极连接电源负极 | |
| D. | 合金的熔点都高于它的成分金属,合金的耐腐蚀性也都比其组成成分金属强 |
5.某气体物质质量为9.6g,含有6.02×1022个分子,则气体的相对分子质量为( )
| A. | 64 | B. | 32 | C. | 96 | D. | 32 |
2.短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,X原子的最外层电子数是内层电子数的3倍,元素Y与W同主族,Z原子的最外层电子数是其电子层数的2倍.下列说法正确的是( )
| A. | 四种元素在自然界中都有游离态 | |
| B. | X分别与W、Y、Z都可组成具有漂白性的物质,且它们的漂白原理相同 | |
| C. | 元素W、Y的氯化物中,各原子(或离子)均满足8电子的稳定结构 | |
| D. | 元素W可与元素X形成一种既含极性键又含非极性键的共价化合物 |
9.某电动汽车配载一种可充放电的锂电子电池.放电时电池的总反应为:Li1-xCoO2+LixC6=LiCoO2+C6(x<1).下列关于该电池的说法不正确的是( )
| A. | 放电时,Co元素的化合价升高 | |
| B. | 放电时,正极的电极反应式为Lil-xCoO2+xe-+xLi+=LiCoO2 | |
| C. | 充电时,Li+在电解质中由阳极向阴极迁移 | |
| D. | 充电时,阴极的电极反应式为C6+xLi++xe-=LixC6 |
6.常吃菠菜可以补铁,这里的“铁”是指( )
| A. | 分子 | B. | 元素 | C. | 原子 | D. | 单质 |
7.(1)25℃时,在0.1L 0.2mol•L-1的HA溶液中,有0.001mol的HA电离成离子,则该溶液的pH=2.
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=0.5amol/L.
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
回答下列问题
?25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
?向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3.
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
(2)25℃时,若向0.1mol/L氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=amol/L,则c(SO42-)=0.5amol/L.
(3)室温下,若向0.1mol/L氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,则所得溶液中各离子的物质的量浓度由大到小的顺序是c(NH4+)>c(SO42-)>c(H+)>c(OH-).
(4)电离平衡常数是衡量弱电解质电离程度强弱的物理量.已知:
| 化学式 | 电离常数(25℃) |
| HCN | K=4.9×l0-10 |
| CH3COOH | K=1.8×l0-5 |
| H2CO3 | K1=4.3×l0-7、K2=5.6×l0-11 |
?25℃时,有等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液,三溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.
?向NaCN溶液中通入少量CO2,所发生反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3.
(5)常温下,在一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的NaHSO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液pH=11.若反应后溶液的体积等于Ba(OH)2溶液与NaHSO4溶液的体积之和,则Ba(OH)2溶液与NaHSO4溶液的体积比是1:4.
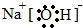 .
.