题目内容
12.按照如图所示接通线路,反应一段时间后,回答下列问题(假设所提供的电能可以保证电解反应的顺利进行):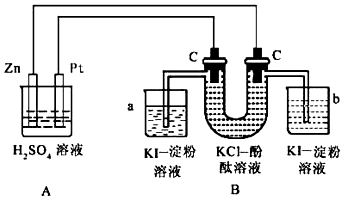
(1)U形管内发生什么现象?左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色.
(2)写出有关反应的化学方程式:A:Zn+H2SO4═ZnSO4+H2↑,
a:2KI+Cl2═2KCl+I2,
B:2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2KOH.
(3)烧杯A 中Zn 电极上的电极反应式:Zn-2e-=Zn2+
(4)在a、b两烧杯中发生的现象:a烧杯中溶液变蓝,b烧杯中有无色气体逸出,溶液无明显变化;
(5)如果小烧杯中有0.508g碘析出,则大烧杯中负极减轻0.13g.
分析 A装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,a中发生反应2KI+Cl2═2KCl+I2,碘遇淀粉试液变蓝色,b中有无色气体生成,淀粉碘化钾溶液不变色,据此分析解答.
解答 解:(1)A装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极、Pt作正极,B为电解池,左边C为阳极,阳极上电极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,阳极上氯离子放电生成黄绿色气体,阴极上生成无色氢气且溶液呈碱性,碱遇酚酞试液变红色,所以U型管中看到的现象是:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色,
故答案为:左侧管内有黄绿色气体逸出,右侧管内有无色气体逸出,右侧溶液由无色变为红色;
(2)A中发生的反应实质上相当于锌和稀硫酸的反应,反应方程式为Zn+H2SO4═ZnSO4+H2↑,
a中氯气和碘离子发生置换反应,反应方程式为2KI+Cl2═2KCl+I2,B中阳极上氯离子放电生成氯气、阴极上氢离子放电,同时阴极附近生成KOH,反应方程式为,
故答案为:Zn+H2SO4═ZnSO4+H2↑;2KI+Cl2═2KCl+I2;2KCl+2H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2↑+2KOH;
(3)A装置能自发的进行氧化还原反应,则为原电池,Zn易失电子作负极,电极反应式:Zn-2e-=Zn2+,故答案为:Zn-2e-=Zn2+;
(4)a中碘遇淀粉试液变蓝色,所以a中溶液变蓝,b中有无色气体生成,碘离子不能被氧化生成碘,所以溶液不变色,
故答案为:a烧杯中溶液变蓝,b烧杯中有无色气体逸出,溶液无明显变化;
(5)如果小烧杯中有0.508g碘析出,析出碘的物质的量=$\frac{0.508g}{254g/mol}$=0.002mol,转移电子的物质的量=2×0.002mol=0.004mol,串联电路中转移电子相等,所以消耗Zn的质量=$\frac{0.004mol}{2}$=0.13g,
故答案为:0.13.
点评 本题考查原电池和电解池原理,明确各个电极上发生的反应是解本题关键,同时考查学生分析问题、解答问题能力,知道常见物质的性质,注意串联电路中转移电子相等,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 150 mL 1mol/L氯化钠溶液 | B. | 75 mL 2mol/L氯化铵溶液 | ||
| C. | 150 mL 1mol/L氯化铁溶液 | D. | 75 mL 1mol/L氯化亚铁溶液 |
| A. | Al2(SO4)3═3Al3++2SO42- | B. | NaHCO3═Na++H++CO32- | ||
| C. | NaHSO4═Na++H++SO42- | D. | K2MnO4═2K++MnO42- |
| ①中的反应物 | ②中的现象 | 实验结论 | 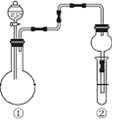 | |
| A | 纯碱、稀硫酸 | 硅酸钠溶液中出现白色沉淀 | 酸性:硫酸>碳酸>硅酸 | |
| B | MnO2、浓盐酸 | 淀粉KI溶液变蓝 | Cl2有氧化性 | |
| C | Na2SO3、硫酸 | 溴水褪色 | SO2有漂白性 | |
| D | Cu、硝酸 | 红棕色气体 | ①中硝酸为浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 该溶液中c(SO42-)=0.2mol/L | |
| B. | 该溶液中c(SO42-)=2c(Al3+) | |
| C. | 该溶液中:3c(Al3+)+c(K+)+c(H+)=2c(SO42-) | |
| D. | 向该溶液中加入2L0.1mol/LBa(OH)2溶液,生成的沉淀为BaSO4 |
| A. | 烧碱 | B. | 纯碱 | C. | 石灰水 | D. | 生石灰 |
| A. |  实验:电流表A指针偏转,碳棒上有红色固体析出 | |
| B. |  实验:电流表A指针偏转,铁极上有无色气体产生 | |
| C. |  实验:碳棒上有无色气体产生,铁极上有黄绿色气体产生 | |
| D. |  实验:粗铜上有红色固体析出,精铜溶解 |