题目内容
6.常吃菠菜可以补铁,这里的“铁”是指( )| A. | 分子 | B. | 元素 | C. | 原子 | D. | 单质 |
分析 食品、药品、营养品、矿泉水等物质中的“铁”等不是以单质、分子、原子等形式存在,而是指元素,通常用元素及其所占质量(质量分数)来描述.
解答 解:常吃菠菜可以补铁,这里的“铁”是指不是以单质、分子、原子等形式存在,这里所指的“铁”是强调存在的元素,与具体形态无关.
故选:B.
点评 本题难度不大,主要考查元素与微观粒子及物质的区别,加深对元素概念的理解是正确解答此类试题的关键.

练习册系列答案
 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案
相关题目
16.下列说法正确的是( )
| A. | 氧化铜的摩尔质量是80 g | B. | 氨气的摩尔质量是17 mol | ||
| C. | 氧气的摩尔质量是32 g•mol-1 | D. | 1 mol氢原子的质量是2 g |
17.利用如图所示装置进行下列实验,根据现象能得出相应实验结论的是( )
| ①中的反应物 | ②中的现象 | 实验结论 | 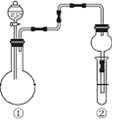 | |
| A | 纯碱、稀硫酸 | 硅酸钠溶液中出现白色沉淀 | 酸性:硫酸>碳酸>硅酸 | |
| B | MnO2、浓盐酸 | 淀粉KI溶液变蓝 | Cl2有氧化性 | |
| C | Na2SO3、硫酸 | 溴水褪色 | SO2有漂白性 | |
| D | Cu、硝酸 | 红棕色气体 | ①中硝酸为浓硝酸 |
| A. | A | B. | B | C. | C | D. | D |
14.下列实验操作能达到实验目的是( )
| 选项 | 实验目的 | 实验操作 |
| A | 检验Fe(NO3)2样品已被氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 |
| B | 提取碘水中碘 | 将碘水倒入分液漏斗,加入适量乙醇,振荡后静置 |
| C | 验证Mg(OH)2沉淀可以转化为 Fe(OH)3沉淀 | 向 2mL1mol•L-1NaOH 溶液中加入2~3 滴 lmol•L-1MgCl2溶液,生成白色沉淀,再加入2~3滴lmol•L-1FeCl3溶液 |
| D | 比较碳和硅的非金属性强弱 | 向饱和的Na2SiO3溶液中通人CO2 |
| A. | A | B. | B | C. | C | D. | D |
1.生产、生活中离不开各类化学物质.下列化合物中属于碱的是( )
| A. | 烧碱 | B. | 纯碱 | C. | 石灰水 | D. | 生石灰 |
18.室温下,使用pH计测定0.1mol/L NH4Cl溶液的pH=5.12.由此可以得到的结论是 ( )
| A. | 溶液中c(H+)>c(OH-) | |
| B. | NH4+水解是微弱的 | |
| C. | NH3•H2O是弱碱 | |
| D. | 由H2O电离出的c(H+)<10-7 mol/L | |
| E. | 物质的量浓度相等的氨水和盐酸等体积混合,溶液pH=7 |
15.要使氯化铝溶液中的Al3+完全转化为Al(OH)3沉淀,选用的合理试剂是( )
| A. | NaOH溶液 | B. | 氨水 | C. | 澄清石灰水 | D. | Mg(OH)2 |
16.某化学兴趣小组的同学利用图所示实验装置进行实验.
(1)气体发生装置中反应的化学方程式是MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释因为饱和食盐水中 C(Cl-)较大,促使平衡 Cl2+H2O?H++Cl-+HClO逆向移动,减少Cl2 的溶解.
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究.
(3)A 中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(4)为了探究现象 II 的原因,甲同学进行如下实验.
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应.
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为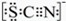
①甲同学认为 SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取 A 中黄色溶液于试管中,加入用盐酸酸化的 BaCl2溶液,产生白色沉淀,由此证明被氧化的元素是硫元素(填名称).
③通过实验证明了 SCN-中氮元素转化为 NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在SCN-中氮元素被氧化成NO3-.中被氧化的元2
④若 SCN-与 Cl反应生成 CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,.
| 操作 | 现象 |
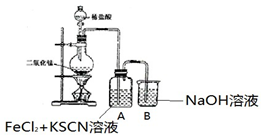 | I.A 中溶液变红 Ⅱ.稍后,溶液由红色变为黄色 |
(2)实验室常用排饱和食盐水的方法来收集 Cl2,试用化学平衡原理加以解释因为饱和食盐水中 C(Cl-)较大,促使平衡 Cl2+H2O?H++Cl-+HClO逆向移动,减少Cl2 的溶解.
以下甲学生对 Cl2 与 FeCl2 和 KSCN 混合溶液的反应进行实验探究.
(3)A 中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(4)为了探究现象 II 的原因,甲同学进行如下实验.
①取 A 中黄色溶液于试管中,加入 NaOH 溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取 A 中黄色溶液于试管中,加入过量的 KSCN 溶液,最终得到红色溶液.
甲同学的实验证明产生现象Ⅱ的原因是 SCN-与 Cl2发生了反应.
(5)甲同学猜想 SCN-可能被 Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
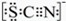
①甲同学认为 SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取 A 中黄色溶液于试管中,加入用盐酸酸化的 BaCl2溶液,产生白色沉淀,由此证明被氧化的元素是硫元素(填名称).
③通过实验证明了 SCN-中氮元素转化为 NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在SCN-中氮元素被氧化成NO3-.中被氧化的元2
④若 SCN-与 Cl反应生成 CO2,写出反应离子方程式SCN-+8Cl2+9H2O=NO3-+SO42-+CO2+16Cl-+18H+,.