题目内容
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6 NA个 | |
| C. | 25℃时,1L0.1mol•L-1FeCl3溶液中含有0.1 NA 个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2 NA |
分析 A.标况下,SO3不是气体;
B.12g石墨和C60的混合物中含有12gC原子,12个C原子的物质的量为1mol,含有6mol质子;
C.水解反应属于可逆反应,胶体微粒是氢氧化铁的集合体;
D.氢氧燃料电池中正极放电的为氧气,1mol氧气完全反应转移4mol电子.
解答 解:A.三氧化硫在标准状况下不是气体,11.2L SO3所物质的量不是0.5mol,故A错误;
B.12g石墨和C60的混合物中含有12个碳原子,含有1mol碳原子,1mol碳原子含有6mol质子,所以混合物中含有的质子总数一定为6NA个,故B正确;
C.水解反应属于可逆反应,0.1molFeCl3水解生成的氢氧化铁少于1mol,胶体微粒是氢氧化铁的集合体,因此含有的Fe(OH)3胶体粒子肯定少于0.1 NA,故C错误;
D.标准状况下22.4L气体的物质的量为1mol,氢氧燃料电池中正极氧气得到电子生成氢氧根离子,1mol氧气完全反应得到4mol电子,则电路中通过的电子数目为4NA,故D错误;
故选B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下的气体摩尔体积的使用条件,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
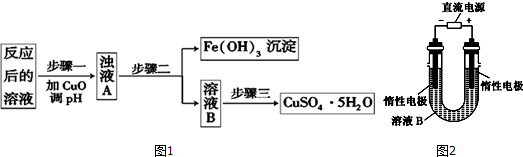
10.A由Al2O3、Fe3O4、Al、Cu中的某几种粉末混合而成,该混合物成分的分析方案如图所示.下列分析不正确的是( )


| A. | 当m2-m3=2.96 g时,Fe3O4的质量至少为2.32g | |
| B. | 生成蓝色溶液的离子方程式为Cu+2Fe3+═Cu2++2Fe2+ | |
| C. | 要确定混合物中是否含有Al,可取A加入适量稀盐酸 | |
| D. | 当m1>m2时,溶液a中的阴离子只有1种 |
7.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | pH=1的NaHSO4溶液:c(H+)=c(SO42-)+c(OH-) | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| C. | CO2的水溶液:c(HCO3-)>c(H+)>c(CO32-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:3c(Na+)═2[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
4.下列有关说法正确的是( )


| A. | 图1装置将化学能转化为电能,电子由锌极经过稀硫酸进入铜极 | |
| B. | 利用图2装置可进行粗铜的精炼,则粗铜做A极 | |
| C. | 若A、B两电极均为铜,利用图2装置电解硫酸铜溶液,则电解后溶液的pH不变 | |
| D. | 利用图2装置可在铁上镀铜,则铁作B极 |
11.有关如图所示原电池的说法正确的是( )
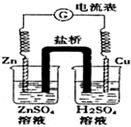

| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
8.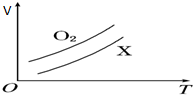 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
 如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )
如图表示1g O2与1g X气体在恒压条件下的密闭容器中体积(V)与温度(T)的关系,则X气体可能是( )| A. | C2H4 (气) | B. | SO2 | C. | CH4 | D. | NO |
9.下列表示物质结构的化学用语或模型正确的是( )
| A. | NaH中氢离子结构示意图: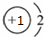 | B. | CH4分子的球棍模型: | ||
| C. | 醛基的电子式: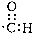 | D. | 对-硝基甲苯的结构简式: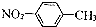 |