题目内容
11.有关如图所示原电池的说法正确的是( )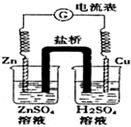
| A. | 随着反应进行,左烧杯中盐溶液浓度上升,右烧杯中酸溶液浓度下降 | |
| B. | 盐桥的作用是让电子通过,以构成闭合回路 | |
| C. | 随着反应进行,右烧杯中溶液pH变小 | |
| D. | 总反应为:2H++Zn═H2↑+Zn2+ |
分析 由图可知,该电池为铜锌原电池,原电池中,活泼金属作负极,负极发生氧化反应,正极发生还原反应,负极反应式为Zn-2e-=Zn2+,正极反应式为2H++2e-=H2↑,原电池中电子由负极流向正极,以此解答该题.
解答 解;A.随着反应进行,左烧杯中锌放电,生成锌离子,盐溶液浓度上升,右烧杯中酸溶液中氢离子放电生成氢气,浓度下降,故A正确;
B.两个烧杯以盐桥中的阴阳离子定向移动形成闭合回路,电子不能经过盐桥,故B错误;
C.右烧杯中发生2H++2e-=H2↑,溶液pH变大,故C错误;
D.原电池工作时的总反应为2H++Zn═H2↑+Zn2+,故D正确.
故选AD.
点评 本题考查原电池知识,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理和电极方程式的书写,难度不大.

练习册系列答案
 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案 高效智能课时作业系列答案
高效智能课时作业系列答案
相关题目
2.有平衡体系CO(g)+2H2(g)?CH3OH(g)△H<0,为增加甲醇的产量,应采取的正确措施是( )
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
19.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 标准状况下,11.2LSO3所含的分子数为0.5NA | |
| B. | 12g石墨和C60的混合物中质子总数一定为6 NA个 | |
| C. | 25℃时,1L0.1mol•L-1FeCl3溶液中含有0.1 NA 个Fe(OH)3胶体粒子 | |
| D. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2 NA |
6.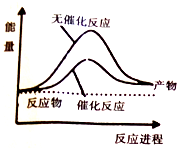 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
一定条件下,在体积1L的密闭容器中加入1mol CO(g)和2mol H2(g)充分反应,生成CH3OH(g)放出热量Q kJ,下列说法正确的是( )
 已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下
已知:CO(g)+2H2(g)?CH3OH(l)△H=-248kJ/mol,蒸发1mol CH3OH(l)需要吸收的能量为157kJ,相关数据如下| H2(g) | CO(g) | CH3OH(g) | |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 1084 | a |
| A. | 上图可表示合成甲醇过程中的能量变化 | |
| B. | a的数值为2047 | |
| C. | Q的数值为91 | |
| D. | 其它条件相同,反应使用催化剂时释放出的能量大于无催化剂时释放出的能量 |
16.下列说法不正确的是( )
| A. | 锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后,再将不溶物用稀盐酸溶解去除 | |
| B. | 常温下pH都等于5的CH3COOH溶液和NH4Cl溶液中,水的电离程度前者比后者大 | |
| C. | BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 | |
| D. | 0.1 mol•L-1CH3COOH溶液加水稀释后,c(OH-)、CH3COOH的电离程度均增大 |
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
 硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答:
硝酸是一种重要的化工原料,工业上一般以氨气为原料来制备硝酸.请回答: A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题:
A、B、C、D、E五种常见元素的核电荷数依次增大.A的基态原子中有2个未成对电子,B是地壳中含量最多的元素,C是短周期中最活泼的金属元素,D与C可形成CD型离子化合物,E的基态3d轨道上有2个电子.请回答下列问题: