题目内容
5.下列有关醛的判断正确的是( )| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
分析 A.缺少碳碳双键的位置;
B.1 mol HCHO含有2mol醛基;
C.甲基也可被高锰酸钾氧化;
D.含有醛基的有机物都可发生银镜反应.
解答 解:A.CH3-CH=CH-CHO名称为2-丁烯醛,故A错误;
B.1 mol HCHO含有2mol醛基,可生成4molAg,故B错误;
C.甲基连接在苯环上,也可被高锰酸钾氧化,故C错误;
D.含有醛基的有机物都可发生银镜反应,但不一定为醛,如甲酸、葡萄糖等,故D正确.
故选D.
点评 本题考查有机物的结构和性质,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意把握有机物的官能团的性质,为解答该题的关键.

练习册系列答案
相关题目
13.能正确表示下列反应的离子方程式是( )
| A. | Fe3O4溶于足量稀HNO3:Fe3O4+8H+=Fe2++2Fe3++4H2O | |
| B. | NH4HCO3溶液与足量Ba(OH)2溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 硫化钠的水解反应:S2-+H3O+HS-+H2O | |
| D. | 将0.2 mol•L-1的NH4Al(SO4)2溶液与0.3 mol•L-1的Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
10.镁铝合金质优体轻,又不易锈蚀,大量用于航空工业、造船工业、日用化工等领域.下列关于镁铝合金的性质的叙述中正确的是( )
| A. | 此合金的熔点、硬度比镁和铝的熔点、硬度都高 | |
| B. | 此合金能全部溶解于稀盐酸中 | |
| C. | 此合金能全部溶解于氢氧化钠溶液中 | |
| D. | 比合金不能全部溶解于过量Fe2Cl3溶液中 |
17.下列说法正确的是( )
| A. | ⅠA族和ⅥA族元素形成的原子个数比为1:1、电子总数为38的化合物,是含共价键的离子化合物 | |
| B. | 在SiO2晶体中,1个硅原子和2个氧原子形成2个共价键 | |
| C. | HI的相对分子质量比HF大,所以HI的沸点比HF高 | |
| D. | H与D、16O与18O互为同位素;H216O、D216O、H218O、D216O互为同素异形体 |
10.某化学兴趣小组利用下列试剂:铁粉、锌粉、0.1mol/L FeCl3溶液,0.1mol/L FeCl2溶液、KSCN溶液、新制氯水,探究Fe2+、Fe3+的氧化性、还原性,并利用实验结论解决一些问题.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
(3)该兴趣小组为说明“Fe2+具有氧化性”,提出了向FeCl2溶液中加入锌粉,观察实验现象的方案,该反应的离子方程式为Fe2++Zn═Zn2++Fe.
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
(1)用所给试剂写出体现Fe2+具有还原性的反应的化学方程式2FeCl2+Cl2=2FeCl3.
(2)设计实验方案,完成下列表格.
| 探究内容 | 实验方案 | 实验现象 |
| 探究Fe3+具有氧化性 | 取少量0.1mol/L FeCl3溶液,往溶液中加入足量铁粉,再加入少量KSCN溶液. | 加入铁粉后,溶液颜色变为浅绿色.加入KSCN溶液后,溶液不变色. |
(4)某反应中反应物与生成物有Fe3+、Mn2+、H+、MnO4-、H2O和一种未知离子X.
①已知MnO4-在反应中得到电子,则X是Fe2+.
②该反应的离子方程式是MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
14.下列关于化学键的说法中不正确的是( )
| A. | 化学键是一种作用力 | |
| B. | 氢键也属化学键 | |
| C. | 化学键可以使离子相结合,也可以使原子相结合 | |
| D. | 化学方应过程中,反应物分子内的化学键断裂,生成物中的化学键形成 |
15.下列现象或事实可用同一原理解释的是( )
| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 氯水和活性炭使红墨水褪色 | |
| C. | 漂白粉和钠长期暴露在空气中变质 | |
| D. | 氯水和过氧化钠使品红褪色 |
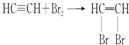
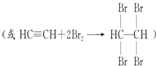
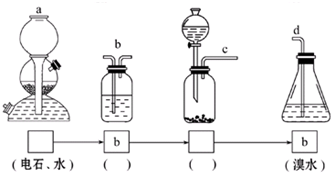
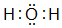 .
.