题目内容
15.下列现象或事实可用同一原理解释的是( )| A. | 浓硫酸和浓盐酸长期暴露在空气中浓度降低 | |
| B. | 氯水和活性炭使红墨水褪色 | |
| C. | 漂白粉和钠长期暴露在空气中变质 | |
| D. | 氯水和过氧化钠使品红褪色 |
分析 A.浓硫酸具有吸水性,浓盐酸具有挥发性;
B.氯水中HClO具有漂白性,活性炭具有吸附性;
C.漂白粉在空气中变质是由于吸收CO2和水生成HClO,然后见光分解,钠是因为与水反应生成氢氧化钠和氢气,与氧气反应生成氧化钠;
D.氯水和过氧化钠都具有强的氧化性,能够氧化有机色素;
解答 解:A.浓硫酸具有吸水性,浓盐酸具有挥发性,长期暴露在空气中浓度降低,分别与吸水性、挥发性有关,故A不选;
B.氯水中HClO具有漂白性,活性炭具有吸附性,原理分别为强氧化性、吸附性,故B不选;
C.漂白粉在空气中变质是由于吸收CO2和水生成HClO,然后见光分解,钠是因为与水反应生成氢氧化钠和氢气,与氧气反应生成氧化钠,二者原理不同,故C不选;
D.氯水和过氧化钠都具有强的氧化性,能够氧化有机色素,所以氯水和过氧化钠使品红褪色原理相同,故D选;
故选:D.
点评 本题元素化合物知识,侧重考查氯气及化合物,把握漂白原理及物质的性质为解答的关键,注重基础知识的考查,题目难度不大.

练习册系列答案
相关题目
5.下列有关醛的判断正确的是( )
| A. | 根据系统命名法,CH3-CH=CH-CHO的名称是:丁烯醛 | |
| B. | 1 mol HCHO发生银镜反应最多生成2 mol Ag | |
| C. | 对甲基苯甲醛( )使酸性高锰酸钾溶液褪色,说明它含有醛基 )使酸性高锰酸钾溶液褪色,说明它含有醛基 | |
| D. | 能发生银镜反应的有机物不一定是醛类 |
6.实验室需要450mL1mol/L的硫酸,现用密度为1.84g/cm3,溶质的质量分数98%的浓硫酸来配制,有关说法正确的是(设NA阿伏加德罗常数的值)( )
| A. | 浓硫酸中硫酸物质的量浓度为18.4 mol/L | |
| B. | 配制溶液所需浓硫酸体积为24mL | |
| C. | 配制溶液时仅需的仪器有容量瓶、烧杯、玻璃棒、量筒 | |
| D. | 配制溶液时,量取硫酸注入到烧杯中,加水稀释,冷却后再转移到容量瓶中 |
3.某电解质溶液的pH=a,向其中插入两惰性电极,通电一段时间后,测知溶液的pH=b.若b≤a,该电解质可能是( )
| A. | Na2S | B. | CuSO4 | C. | NaCl | D. | Na2SO4 |
10.将乙醇滴入热的浓硫酸中,发生反应:C2H5OH+6H2SO4=6SO2↑+2CO2↑+9H2O,浓硫酸没有体现的性质是( )
| A. | 氧化性 | B. | 脱水性 | C. | 酸性 | D. | 吸水性 |
20.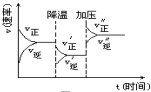 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
 如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )
如图是可逆反应A+2B?2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断( )| A. | 逆反应是放热反应 | B. | 正反应是放热反应 | ||
| C. | 若A、B是气体,则D一定是气体 | D. | A、B、C、D均为气体 |
7.交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,因为酒中的乙醇分子能使橙红色的重铬酸钾变为绿色的物质.在K2Cr2O7中铬(Cr)元素的化合价是( )
| A. | +2 | B. | +3 | C. | +6 | D. | +7 |
4.下列除杂质(括号中物质为杂质)所用试剂或方法不正确的是( )
| A. | SiO2(CuO):HCl | B. | MgO(Al2O3):NaOH溶液 | ||
| C. | Na2SiO3溶液(Na2CO3):过量的CO2 | D. | CO2(HCl):饱和NaHCO3溶液 |