题目内容
10.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,采用最简便的分离方法是( )| A. | .蒸发 | B. | 分液 | C. | .蒸馏 | D. | 萃取 |
分析 根据花生油和水是互不相溶的两种液体,分层,所以可采用分液的方法进行分离进行解答.
解答 解:花生油中不小心混入了大量的水,水与油分层,应选择分液法分离,而蒸发分离可溶性固体与液体、蒸馏分离互溶但沸点不同的液体、萃取分离溶解性差异较大的混合物,
故选B.
点评 本题考查物质的分离、提纯方法及选择,为高频考点,把握物质的性质及分离原理为解答的关键,注意物质性质差异及分离方法的选择,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.M(NO3)2热分解化学方程式为:2M(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2MO+4NO2↑+O2↑,加热59.2g M(NO3)2使其完全分解,在标准状况下收集22.4L的气体,那么M的摩尔质量是( )
| A. | 24g/mol | B. | 74g/mol | C. | 148g/mol | D. | 40g/mol |
18.A、B、C、D、E是原子序数依次增大的前四周期的常见元素.已知:
(1)写出E原子基态核外电子排布式1s22s22p63s23p63d104s1.比较B、C、D电负性的大小顺序C<N<O.(按由小到大)
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.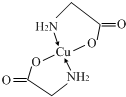 .
.
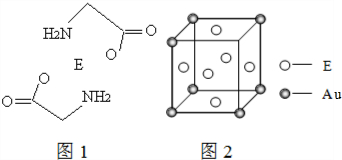
(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.
| A | 原子半径最小 |
| B | 核外3个能级上的电子数相等 |
| C | 其氢化物的沸点比同族相邻周期元素氢化物的沸点高 |
| D | 2p轨道上成对电子数与未成对电子数相等 |
| E | N层电子数为1,内层轨道全部排满电子 |
(2)与C2互为等电子体的分子有CO,离子有CN-或C22-.
(3)E2+离子与氨基乙酸根离子(H2NCH2COO-)结合得到电中性的配合物(如图1),画出其中E2+离子与N、O原子间的化学键.
 .
.(4)E和金(Au)形成的合金的晶胞结构如图2,则该合金的化学式可表示为Cu3Au.

5.含8.0g NaOH 的溶液中通入一定量CO2后,将得到的溶液低温小心蒸干,称得无水物9.3g,则该无水物中一定含有的物质是( )
| A. | Na2CO3 | B. | NaHCO3 | C. | Na2CO3 和NaHCO3 | D. | NaOH和Na2CO3 |
15.在电解质溶液中,一定相等的是( )
| A. | 阴离子数和阳离子数 | |
| B. | 阳离子的正电荷总数和阴离子的负电荷总数 | |
| C. | 阴、阳离子的质量 | |
| D. | 每个阳离子与每个阴离子所带的电荷 |
2. I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
 I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )
I2在KI溶液中存在平衡:I2(aq)+I-(aq)═I3- (aq),某I2、KI混合溶液中,c(I3-)与温度T的平衡曲线图如下.下列说法不正确的是( )| A. | 反应I2(aq)+I-(aq)═I3- (aq)的△H>0 | |
| B. | 若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1>K2 | |
| C. | 若反应进行到状态D时,一定有v正>v逆 | |
| D. | 状态A与状态B相比,状态A的c(I2) 小 |
19.下列叙述错误的是( )
| A. | 生铁中含有碳,抗腐蚀能力比纯铁弱 | |
| B. | 用锡焊接的铁质器件,焊接处易生锈 | |
| C. | 水库的钢闸门连电源正极不易被腐蚀 | |
| D. | 轮船船体镶嵌锌块,船体不易被腐蚀 |
20.已知丙烷的燃烧热△H=-2 215kJ•mol-1,若一定量的丙烷完全燃烧后生成3.6g水,则放出的热量约为( )
| A. | 110 kJ | B. | 440 kJ | C. | 1100 kJ | D. | 2216 kJ |
 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题:
能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务.阅读下列有关能源的材料,回答有关问题: