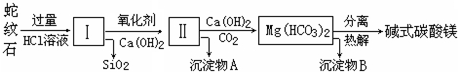
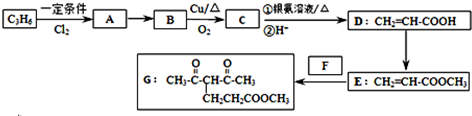
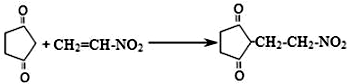
题目内容
设 NA为阿伏加德罗常数,下列有关叙述不正确的是( )
| A、常温常压下,1 mol 甲基(-CH3)所含的电子数为 9NA |
| B、质子总数为 5NA的重水(D2O )物质的量是0.5 mol |
| C、0.1 mol Na2O2与水反应时,转移的电子数为 0.2NA |
| D、常温常压下,NA 个甲烷分子的体积大于 22.4L |
考点:阿伏加德罗常数
专题:
分析:A、甲基不显电性;
B、1mol重水含10mol质子;
C、Na2O2与水的反应为歧化反应;
D、常温常压下,气体摩尔体积大于22.4L/mol;
B、1mol重水含10mol质子;
C、Na2O2与水的反应为歧化反应;
D、常温常压下,气体摩尔体积大于22.4L/mol;
解答:
解:A、甲基不显电性,故1mol甲基含9mol电子,故A正确;
B、1mol重水含10mol质子,故含质子总数为 5NA的重水(D2O )物质的量是0.5 mol,故B正确;
C、Na2O2与水的反应为歧化反应,1molNa2O2转移1mol电子,故0.1molNa2O2转移0.1mol电子,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故NA 个甲烷分子即1mol甲烷的体积大于22.4L,故D正确;
故选C.
B、1mol重水含10mol质子,故含质子总数为 5NA的重水(D2O )物质的量是0.5 mol,故B正确;
C、Na2O2与水的反应为歧化反应,1molNa2O2转移1mol电子,故0.1molNa2O2转移0.1mol电子,故C错误;
D、常温常压下,气体摩尔体积大于22.4L/mol,故NA 个甲烷分子即1mol甲烷的体积大于22.4L,故D正确;
故选C.
点评:本题考查了阿伏伽德罗常数的有关计算,掌握公式的使用和物质的结构、状态是解题关键,难度不大.

练习册系列答案
相关题目
将pH=11NaOH溶液和pH=3的甲酸(弱酸)溶液以等体积混合后,对所得溶液,下列判断一定正确的是( )
| A、c(HCOO-)<c(Na+) |
| B、c(HCOO-)>c(Na+) |
| C、c(OH-)>c(H+) |
| D、c(OH-)>c(HCOO-) |
已知在酸性溶液中的还原性强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,下列反应不可能发生的是( )
| A、H2O2+H2SO4=SO2↑+O2↑+2 H2O |
| B、2I-+2Fe3+=I2+2 Fe2+ |
| C、2Fe3++SO2+2 H2O=2Fe2++SO42-+4H+ |
| D、SO2+2 H2O+I2=H2SO4+2HI |
在人口居住密度较大的城区和建筑群中,室内空气的污染有时会比室外更严重.下列室内空气污染物中属于无机物的是( )
| A、甲醛(HCHO) |
| B、苯(C6H6) |
| C、甲苯(C7H8) |
| D、一氧化碳(CO) |
下列物质中,属于纯净物的是( )
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
①陶瓷,②水泥,③玻璃,④漂白粉,⑤胆矾,⑥氯水,⑦液氯.
| A、③⑦ | B、③④⑥ | C、⑤⑦ | D、⑥⑦ |