题目内容
蛇纹石是一种富镁硅酸盐矿物的总称,因其颜色青绿相间酷似蛇皮而得名.蛇纹石可以看作由MgO、FeO和
Fe2O3、Al2O3、SiO2组成.工业上由蛇纹石制取碱式碳酸镁产品的流程如下:
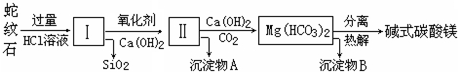
(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是 .
(2)向Ⅰ中加入氧化剂的作用是 ,
加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
若pH>8可能会导致 溶解、 沉淀.
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入 ,然后过滤、洗涤、 (填写实验操作名称),即可获得红色颜料,实现废物的综合利用.
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是 (填写物质化学式).
(5)若产品的化学式用aMgCO3?bMg(OH)2?cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L
CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a= ,b= ,c= .
Fe2O3、Al2O3、SiO2组成.工业上由蛇纹石制取碱式碳酸镁产品的流程如下:

(1)蛇纹石加盐酸溶解后,溶液里除了Mg2+、Al3+外,还含有的金属离子是
(2)向Ⅰ中加入氧化剂的作用是
加入Ca(OH)2时,需要控制溶液pH在7~8之间(有关氢氧化物沉淀的pH见下表).
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 9.4 |
(3)沉淀物A可作为提取红色颜料的原料,若向沉淀物A中加入
(4)物质循环使用,能节约资源.上述实验中,可以循环使用的物质是
(5)若产品的化学式用aMgCO3?bMg(OH)2?cH2O表示,现称取18.2g产品并使之完全分解,收集到3.36L
CO2(标准状况下)和8.0g MgO,通过计算确定产品的化学式中:a=
考点:制备实验方案的设计,常见金属元素的单质及其化合物的综合应用
专题:
分析:(1)蛇纹石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2组成,蛇纹石加盐酸溶解后,MgO、FeO、Fe2O3、Al2O3和HCl反应溶解,而SiO2和HCl不反应,不能溶解;
(2)这时溶液中的Fe3+、Al3+是杂质,但除去Fe3+、Al3+的过程中一定不能将Mg2+损失,为了达到这个目的,根据题中提示应用的原理是Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8;若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失;
(3)制纯净Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;
(4)此过程中CO2是可以重复使用的;
(5)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,依据需定的数据样品质量,结合元素守恒计算得到;
(2)这时溶液中的Fe3+、Al3+是杂质,但除去Fe3+、Al3+的过程中一定不能将Mg2+损失,为了达到这个目的,根据题中提示应用的原理是Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8;若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失;
(3)制纯净Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质;
(4)此过程中CO2是可以重复使用的;
(5)确定产品aMgCO3?bMg(OH)2?cH2O中a、b、c的值,依据需定的数据样品质量,结合元素守恒计算得到;
解答:
解:(1)蛇纹石加盐酸溶解,MgO、FeO、Fe2O3、Al2O3和HCl反应溶解,反应方程式分别为:MgO+2HCl=MgCl2+H2O,FeO+2HCl=FeCl2+H2O,Fe2O3+6HCl=2FeCl3+3H2O,Al2O3+6HCl=2AlCl3+3H2O.而SiO2不与盐酸反应,以沉淀的形式除去,故溶液里除了Mg2+、Al3+外,还含有的金属离子是Fe3+、Fe2+;
故答案为:Fe3+、Fe2+;
(2)这时溶液中的Fe3+、Fe2+、Al3+是杂质,但除去Fe3+、Fe2+、Al3+的过程中一定不能将Mg2+损失,为了达到这个目的,先加入氧化剂,将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,根据题中提示应用的原理是Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8;若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失;
故答案为:将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3;Al(OH)3;Mg2+;
(3)制纯净Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质.
Al(OH)3能溶于强碱;故可A中加入氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铁沉淀,灼烧氢氧化铁沉淀得到氧化铁;离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;2Fe(OH)3
Fe2O3+3H2O
故答案为:NaOH溶液;灼烧;
(4)依据流程分析,反应过程中参加费用,最后有生成可以循化使用,所以此过程中CO2是可以重复使用的;
故答案为:CO2;
(5)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
(a+b)MgO+aCO2↑+(b+c)H2O↑,
根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,
则m(MgO)═0.2mol,
n(CO2)═0.15mol,
n(H2O)═0.2mol,
得:a:b:c=0.15:0.05:0.15=3:1:3,
故答案为:3;1;3.
故答案为:Fe3+、Fe2+;
(2)这时溶液中的Fe3+、Fe2+、Al3+是杂质,但除去Fe3+、Fe2+、Al3+的过程中一定不能将Mg2+损失,为了达到这个目的,先加入氧化剂,将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3,根据题中提示应用的原理是Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,只要加入一种能消耗H+的物质即可使上述水解平衡向正反应方向移动,除去Fe3+、Al3+,该方案使用加Ca(OH)2的方法,但此步加入Ca(OH)2不能太多,需将溶液的pH控制在7~8;若pH小于7,Al3+不能完全沉淀;若pH过高导致生成的Al(OH)3又发生反应Al(OH)3+OH-=AlO2-+2H2O而溶解,同时Mg2+也转化为沉淀而损失;
故答案为:将Fe2+氧化成Fe3+或将Fe(OH)2氧化成Fe(OH)3;Al(OH)3;Mg2+;
(3)制纯净Fe2O3,应先将其中含有的少量Al(OH)3除去,除去Al(OH)3的方法是利用它能溶于强碱的性质.
Al(OH)3能溶于强碱;故可A中加入氢氧化钠,氢氧化铝与氢氧化钠反应生成偏铝酸钠,偏铝酸钠与二氧化碳反应生成氢氧化铝沉淀和碳酸氢钠,过滤得到氢氧化铁沉淀,灼烧氢氧化铁沉淀得到氧化铁;离子方程式为:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-;2Fe(OH)3
| ||
故答案为:NaOH溶液;灼烧;
(4)依据流程分析,反应过程中参加费用,最后有生成可以循化使用,所以此过程中CO2是可以重复使用的;
故答案为:CO2;
(5)m(样品)=18.2g,m(CO2)=6.6g,m(MgO)=8.0g,碱式碳酸镁分解:aMgCO3?bMg(OH)2?cH2O
| ||
根据质量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,
则m(MgO)═0.2mol,
n(CO2)═0.15mol,
n(H2O)═0.2mol,
得:a:b:c=0.15:0.05:0.15=3:1:3,
故答案为:3;1;3.
点评:本题主要考查元素化合物中金属铝、铁的性质,解题时不仅需熟知物质间的反应原理,还需灵活运用于实验的设计,难度较大.

练习册系列答案
相关题目
下列说法中正确的是( )
| A、KClO3和SO3溶于水后能导电,故KClO3和SO3为电解质 |
| B、升高温度能降低反应活化能,所以反应速率加快 |
| C、中和热测定实验中需要用到的玻璃仪器有烧杯、温度计和环形玻璃棒搅拌棒三种 |
| D、等量的CH4在氧气中燃烧放出的热量与形成燃料电池放出的热量一样多 |
设 NA为阿伏加德罗常数,下列有关叙述不正确的是( )
| A、常温常压下,1 mol 甲基(-CH3)所含的电子数为 9NA |
| B、质子总数为 5NA的重水(D2O )物质的量是0.5 mol |
| C、0.1 mol Na2O2与水反应时,转移的电子数为 0.2NA |
| D、常温常压下,NA 个甲烷分子的体积大于 22.4L |
几种可燃物的燃烧热△H如表所示:
工业上,在高温下利用CH4与CO2反应制备合成气CO与H2,则反应:CH4(g)+CO2(g)═2CO(g)+2H2(g)△H等于( )
| 物质 | CH4 | CH3OH(l) | CH3CH2OH(l) | CO(g) | H2(g) |
| 燃烧热△H/kJ?mol-1 | -890.31 | -726.51 | -1366.8 | -283 | -285.8 |
| A、-247.3kJ?mol-1 |
| B、+247.3kJ?mol-1 |
| C、+321.5kJ?mol-1 |
| D、-321.5kJ?mol-1 |
在配制500ml 0.1mol/L的H2SO4溶液时,下列操作中会导致结果偏高的是( )
| A、洗净的容量瓶未经干燥就用于配制溶液 |
| B、未等溶液降至室温就转移至容量瓶 |
| C、转移溶液时不慎洒到容量瓶外 |
| D、定容时仰视刻度线 |

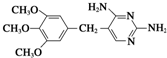 的副产物,为了使该产物的含量降到最低,需要合成路线中第
的副产物,为了使该产物的含量降到最低,需要合成路线中第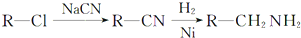 .化合物
.化合物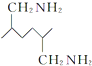 是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH
是合成染料的中间体,请写出以氯乙烷为原料制备该化合物的合成路线流程图(无机试剂任用).合成路线流程图示例如下:CH3CH2OH

