题目内容
鲍林的电负性是以最活泼的非金属元素作为标度计算出来的,该元素是( )
| A、氧 | B、氯 | C、氟 | D、硫 |
考点:元素电离能、电负性的含义及应用
专题:元素周期律与元素周期表专题
分析:电负性是以氟的电负性为4.0作为相对标准.
解答:
电负性表示对键合电子的吸引力,电负性越大对键合电子吸引力越大,所以非金属性越强电负性越强,故电负性最强的物质在周期表的右上角,电负性是以氟的电负性为4.0作为相对标准,故C正确;
故选C.
故选C.
点评:本题考查了电负性的概念,属于基础知识的考查,注意把握有关概念.

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
设NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A、铁与足量稀硝酸反应,1 mol Fe失去电子数为3NA |
| B、常温常压下,22.4L 乙烯中含极性共价键数目为5NA |
| C、1 mol Cu与足量浓硫酸反应产生2NA个SO2分子 |
| D、1 mol冰醋酸和1 mol乙醇在浓硫酸加热下充分反应生成H2O个数为NA |
设NA是阿伏加德罗常数的数值,下列说法正确的是( )
| A、常温下,50g SO2和CO2的混合气体中可能含有2NA个氧原子 |
| B、1mol Cl2与足量的铁反应,转移的电子数为3NA |
| C、1L0.1mol?L-1氨水含有0.1lNA个OH- |
| D、1mol甲醇中含有C-H键的数目为3NA |
下列研究分析方法正确的是( )
| A、分别测定SO2、CO2饱和溶液的PH,可比较H2SO3、H2CO3二酸的强弱 |
| B、先滴入少量氯水,后滴入KSCN试液,可确定溶液中是否含Fe2+ |
| C、25℃若测知氨水与NH4Cl混合溶液的pH>7,可确定溶液中c(NH4+)>c(Cl-) |
| D、固体NH2COONH4(s)在密闭容器中存在:NH2COONH4(s)?2NH3(g)+CO2(g)△S>0,由此可确定反应的△H<0 |
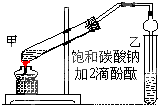 实验室制取乙酸乙酯的主要步骤如下:
实验室制取乙酸乙酯的主要步骤如下: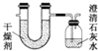 已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).
已知某种燃料含有碳、氢二种元素.为了测定这种燃料中碳和氢两种元素的质量比,可将气态燃料放入足量的O2中燃烧,并将产生的气体全部通过图示装置,得到如表所列的实验数据(产生的气体完全被吸收).