题目内容
20.设NA为阿伏加德罗常数.下列关于0.2mol•L-1 Ba(NO3)2溶液的说法不正确的是(忽略水的电离)( )| A. | 1L溶液中含阴、阳离子总数是0.6NA | |
| B. | 500mL溶液中Βa2+的浓度是0.2mol•L-1 | |
| C. | 500mL溶液中NO-3的浓度是0.4mol•L-1 | |
| D. | 1L溶液中含有0.2NA个NO-3 |
分析 A、求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含3mol离子;
B.离子的浓度与溶液的体积无关;
C.离子的浓度与溶液的体积无关;
D.求出Ba(NO3)2的物质的量,而1molBa(NO3)2中含2molNO3-.
解答 解:A、1L溶液中Ba(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含3mol离子,故0.2molBa(NO3)2中含0.6mol离子,含阴、阳离子总数是0.6NA,故A正确;
B.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中Ba2+的浓度为0.2mol/L,故B正确;
C.离子的浓度与溶液的体积无关,故0.2mol/LBa(NO3)2溶液中NO3-的浓度为0.4mol/L,故C正确;
D.1LBa(NO3)2的物质的量n=CV=0.2mol/L×1L=0.2mol,而1molBa(NO3)2中含2molNO3-,故0.2molBa(NO3)2中含0.4molNO3-,故D错误;
故选D.
点评 本题考查了物质的量浓度的含义、微粒物质的量和浓度的计算应用,掌握基础是解题关键,题目难度不大.

练习册系列答案
相关题目
11.对蛋白质的组成与性质的叙述正确的是( )
| A. | 蛋白质在酶的作用下水解的最终产物为氨基酸 | |
| B. | 向蛋白质溶液加入(NH4)2SO4浓溶液,会使其变性 | |
| C. | 天然蛋白质仅由碳、氢、氧、氮四种元素组成 | |
| D. | 氨基酸和蛋白质都是只能和碱反应的酸性物质 |
3.硝酸铝是一种常用皮革鞣剂.工业上用铝灰(主要合Al、Al2O3、Fe2O3等)制取硝酸铝晶体[Al(NO3)3﹒nH2O]的流程如下:
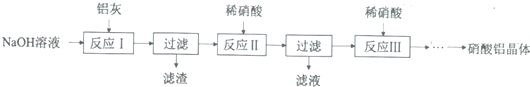
完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:
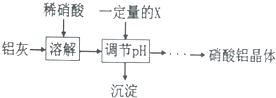
调节pH的目的是将Fe3+转化为Fe(OH)3沉淀除去.
为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.

完成下列填空:
(1)用NaOH固体配制30%的NaOH溶液,所需的玻璃仪器除烧杯外,还有b.
a容量瓶 b量筒 c.烧瓶
(2)反应Ⅱ中为避免铝的损失,需要解决的问题是如何控制反应终点(或硝酸的用量).
(3)从反应Ⅲ所得溶液中得到硝酸铝晶体的步骤依次是:减压蒸发、冷却结晶、过滤、洗涤、低温烘干.
(4)有人建议将反应Ⅱ、Ⅲ合并以简化操作,说明工业上不采用这种方法的原因产物中杂质NaNO3的含量较高.
(5)某同学在实验室用铝灰制各硝酸铝晶体,其流程如下:

| 氢氧化物 | Fe(OH)3 | Al(OH)3 |
| 开始沉淀pH | 1.9 | 4.2 |
| 沉淀完全pH | 3.2 | 5.4 |
为使得到的硝酸铝晶体较纯净,所用的X物质可以是BC(填编号).
A.氨水 B.铝 c.氢氧化铝 D.偏铝酸钠
(6)该实验室制法与工业上制法相比,其缺点是产生大量污染性气体NO等.
(7)称取7.392g硝酸铝晶体样品,加热灼烧使其分解完全,最终得到1.020gAl2O3,计算硝酸铝晶体样品中结晶水的数目为8.7.
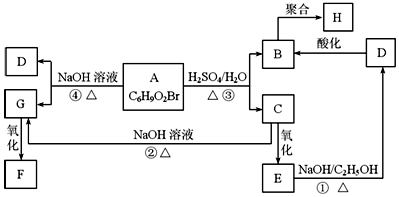 有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.
有机物A、B、C、D、E、F、G、H相互转化关系如图所示.5.2g F能与100mL 1mol/L NaOH溶液恰好完全中和,0.1molF还能与足量NaHCO3反应在标准状况下放出4.48LCO2.D的分子式为C3H3O2Na,E的分子中含有羧基.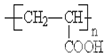 ;
;